Platinum-based chemotherapy in urinary bladder cancer – 10 years clinical experiences
DOI: 10.22591/magyurol.2019.2.modoso.58
Authors:
Módos Orsolya dr.1, Bozsaki Ákos1, Nagy Cintia1, Nagy Nikolett1, Csizmarik Anita1, Keresztes Dávid1, Oláh Csilla1, Váradi Melinda1, Horváth András dr.1, Szendrői Attila dr.1, Szűcs Miklós dr.1, Keszthelyi Attila dr.1, Nyirády Péter dr.1, Szarvas Tibor dr.1,2
1Semmelweis Egyetem ÁOK, Urológiai Klinika és Uroonkológiai Centrum, Budapest (igazgató: Nyirády Péter dr.);
2Duisburg-Esseni Egyetem, Urológiai Klinika, Essen
Summary
Objective: Cisplatin-based chemotherapy is the first-line treatment for locally advanced and metastatic bladder cancer. Novel checkpoint inhibitor therapies are approaching and are currently approved for second-line treatment. In this retrospective study, we report our 10-years single institution experiences with cisplatin-based chemotherapy.
Patients and methods: We collected clinicopathological and follow-up data of bladder cancer patients treated with platinum-based chemotherapy in our clinic between 2007 and 2017. Correlations between clinicopathological and follow-up data have been evaluated and compared to those published in the literature.
Results: Our internal database search identified 135 bladder cancer patients with sufficient data who received cisplatin-based chemotherapy. Of these patients 97 were men (72%) and 38 were women (28%). At the time of diagnosis, the median age was 63 years (40-82 years). We grouped patients based on the indication of chemotherapy: 1) Adjuvant chemotherapy was performed in patients with locally advanced (pT3/T4, N0; n=42/135; 31.1%) and/or with lymph node metastatic cases (pT1/T2, N+, n=19/135; 14.1% or pT3/pT4 and N+, n=28/135; 20,7%). 2) Induction chemotherapy was performed in those patients who had tumor progression after surgical treatment (local recurrence n=5/135; 3.7%, distant organ metastases n=7/135; 5.2% and distant lymph node metastases n=1/135; 0.8%). 3) Patients who were unfit for radical cystectomy received palliative chemotherapy (n=33/135; 24.4%).
Patients who received induction chemotherapy had the most unfavourable survival (p<0.001). In the induction chemotherapy group patients with lymph node metastasis had a significant better prognosis compared to those with local recurrence or distant metastasis (p=0.036). Diabetes mellitus proved to be a significant risk factor for patients’ survival (p=0.027). Patients who showed a radiographic response to chemotherapy had a significant better survival (p=0.047).
Conclusions: Our analysis demonstrated that the indication of chemotherapy, the progression site and diabetes mellitus have a significant impact on survival of platinum-treated bladder cancer patients. Therapy predictive models for cisplatin-based chemotherapy implementing molecular features of bladder cancer are needed to improve therapeutic decision making.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 2. SZÁM
Összefoglalás
Bevezetés: Az invazív húgyhólyagdaganat disszeminációjának megállítására első vonalban a platinaalapú kemoterápia áll rendelkezésünkre. Ez a kezelés azonban csupán a betegek körülbelül felében bizonyul hatékonynak. Jelen vizsgálataink célja az volt, hogy Intézetünkben a kemoterápiával kezelt hólyagrákos betegek klinikopatológiai adatait feltérképezve információt nyerjünk arról, hogy azok hatással vannak-e a platinaalapú kezelés hatékonyságára, illetve a betegség kimenetelére.
Betegek és módszerek: A Semmelweis Egyetem Urológiai Klinikáján 2007 és 2017 között platinaalapú kemoterápiával kezelt hólyagrákos betegek adatait gyűjtöttük össze. Összefüggéseket kerestünk a klinikai paraméterek és a betegek progressziómentes és teljes túlélése között.
Eredmények: Összesen 135 beteg adatait dolgoztuk fel, akik között 97 férfi (72%) és 38 nő (28%) szerepelt. A medián életkor a kezelés megkezdésekor 63 év volt (40–82). A kemoterápia indikációja szerint három csoportot különböztettünk meg: 1) Adjuváns kezelésben részesültek azok a betegek, akik a cystectomia szövettani eredménye szerint lokálisan előrehaladott lelettel (n=42/135; 31,1%) és/vagy nyirokcsomó-áttéttel (n=19/135; 14,1%) vagy mindkettővel (n=28/135; 20,7%) rendelkeztek. 2) Induktív kezelésben részesültek, akiknek a tumora a cystectomia után progrediált (lokális recidíva n=5/135; 3,7%, távoli szervi metasztázis n=7/135; 5,2%, és nyirokcsomóáttét n=1/135; 0,8%). 3) Palliatív kezelésben részesültek azok a betegek, akiknél radikális sebészi kezelésre nem volt lehetőség (n=33/135; 24,4%).
Az induktív kezelésben részesülők tumora a cystectomia után progrediált (lokális recidíva n=5/135; 3,7%, távoli szervi metasztázis n=7/135; 5,2%, és nyirokcsomóáttét n=1/135; 0,8%). Palliatív kezelés esetén radikális sebészi kezelésre nem volt lehetőség (n=33/135; 24,4%). Eredményeink alapján az induktív terápiában részesülők túlélése volt a legkedvezőtlenebb (p<0,001). A nyirokcsomóáttét megléte szignifikánsan jobb prognózissal járt együtt (p=0,036). A cukorbetegség szignifikáns rizikófaktornak bizonyult a túlélés tekintetében (p=0,027). A kezelés alatt radiológiai progressziót nem mutató páciensek szignifikánsan tovább éltek (p=0,047).
Következtetések: Eredményeink alapján a kemoterápia indikációja, a progresszió típusa, valamint a cukorbetegség lényegesen befolyásolhatja a platinaalapú kezelésnek alávetett betegek túlélését. E klinikai paraméterek mellett a tumorok molekuláris sajátságait is figyelembe vevő predikciós módszerekre lenne szükség a terápiás döntések hatékonyságának javítása érdekében.
Bevezetés
A húgyhólyag rosszindulatú daganatát – elkülönítve a prosztatadaganattól – először a 19. században diagnosztizálták külön entitásként (1). A húgyhólyagdaganatok körülbelül negyede már a diagnózis pillanatában izominvazív, vagy a betegség progressziója következtében válik azzá (2). Az izominvazív hólyagdaganatok gyakran multimodális kezelést igényelnek, amelynek részét képezi a lokális kezelésen túl a szisztémás kezelés is. Az első kemoterápiás szerek felfedezéséhez a történelem egyik legmegrázóbb eseménye, a II. világháború vezetett, amely alatt a Yale Egyetem Professzorai, Alfred Gilman és Louis Goodman felfedezte a vegyi fegyverként használt nitrogén-mustár daganatellenes hatását (1946). Nem sokkal később Faber már az MVAC (metotrexát, vinblasztin, doxorubicin, ciszplatin) kombinált kezelés egyik alkotóeleméről, a folsav-antagonista metotrexátról tett közzé ígéretes eredményeket (1948). Közel 10 évvel később, 1960-ban az MVAC egy másik alkotó eleme, a vinca-alkaloidok közé tartozó doxorubicin daganatellenes hatását írta le Eli Lilly (3). Az első kemoterápiás szereket elsősorban hematológiai betegségek kezelésére alkalmazták, az MVAC-kezelés csupán 1985 után terjedt el a hólyagrák adjuváns kezelésében. A hólyagrák szisztémás kezelésében igazi áttörésnek számított a ciszplatin megjelenése. A ciszplatint először M. Peyrone szintetizálta 1844-ben, a tudományos érdeklődés fókuszába azonban csak 1960-ban került, amelynek eredményeképpen 1978-ban az FDA jóváhagyta alkalmazását a daganatellenes terápiában (4). A következő újdonságot már a 2000-es évek hozták, amikor az MVAC-kezeléssel azonos eredményességű, kedvezőbb toxicitású gemcitabin-ciszplatin (GC) kombinált kemoterápia alkalmazása terjedt el az előrehaladott vagy áttétes betegek kezelésében.
Az izominvazív hólyagdaganatok neoadjuváns kezelése szintén a 2000-es években került előtérbe. A neoadjuváns kezelés a következő előnyöket hozhatja magával: a kezelés következtében a daganat stádiuma csökkenhet (downstaging) – amely a műtét elvégzését teheti lehetővé –, lehetőséget ad különböző kemoterápiás szerekre való in vivo érzékenységének megítélésére, továbbá a neoadjuváns kezelésre való érzékenység egy fontos prognosztikai faktor (5). Ellene szól azonban, hogy alkalmazása a radikális műtét elvégzését körülbelül három hónappal tolja el, ami olyan betegeknél, akik nem reagálnak a neoadjuváns kemoterápiára, jelentős időveszteséget jelent. A ciszplatinalapú neoadjuváns kezelés az Európai Urológus Társaság irányelveinek ajánlása ellenére még mindig csak alacsony arányban választott kezelési forma hazánkban.
Az MVAC neoadjuváns kezelés előnyeit és toxicitását az INT-0800 tanulmány foglalta össze, amely 307, pT2-pT4 stádiumú hólyagrákos beteget osztott véletlenszerűen 2 csoportba. Az egyik csoportban a páciensek 3 ciklus MVAC, majd sebészi kezelésben részesültek, a másik csoport betegein kizárólag radikális cystectomiát végeztek. A tanulmány szignifikánsan nagyobb teljes patológiai választ és kedvezőbb túlélést talált az MVAC-cal kezelt betegcsoportban a csak sebészileg kezelt csoporthoz képest. A kezeléssel összefüggésben azonban magas arányban észleltek súlyos hematológiai (57%) és gasztrointesztinális (16%) mellékhatásokat (6). Egy másik tanulmány, az EORT 30894 közel 1000 lokálisan előrehaladott hólyagrákos beteget vizsgált, akik egy része 3 ciklus CMV (ciszplatin, metotrexat, vinblastin) neoadjuváns kezelésben, míg másik része sebészi vagy teljes dózisú sugárterápiában részesült. Nyolc év betegkövetés után statisztikailag szignifikáns haszon mutatkozott a teljes túlélésben a neoadjuváns kezelés javára (5). Egy további tanulmány az MVAC- és a GC-kezelés hatékonyságát 405 beteg bevonásával hasonlította össze. A vizsgálat során a kétféle kombinált kezelés közel azonos hatékonysága igazolódott: a teljes túlélés 14,0 és 15,2 hónap (GC vs. MVAC), a progressziómentes túlélés pedig 7,7, illetve 8,3 hónap volt a vizsgált betegcsoportokban (7). Bár a tanulmányok azt mutatják, hogy a két kezelés megegyező hatékonysággal rendelkezik, a GC-kezelést mégis előszeretettel alkalmazzuk az MVAC-kezeléssel szemben a kedvezőbb mellékhatásprofilja miatt.
A hólyagrák ellátásában a hagyományos sebészi és kemoterápiás kezelések mellett az utóbbi időben az immunterápia is teret nyert. A modern immunterápiák leginkább az immun-checkpoint fehérjék gátlására fókuszálnak. A számos molekuláris célpont közül a hólyagrák kezelésében a PD-1 (programmed cell death protein-1), a PD-L1 (programmed death ligand-1) és a CTLA4 (citotoxyc T-lymphocyte associated protein 4) kiemelten fontos. A nagyobb mennyiségben PD-L1-et kifejező hólyagdaganatok magasabb grade-del rendelkeznek, gyakoribb a tumorrecidíva és a betegek túlélése is kedvezőtlenebb (8). Az atezolizumab volt az első PD-L1-gátló monoklonális antitest, amelyet a hólyagrák kezelésében engedélyeztek. Jelenleg az atezolizumab és a pembrolizumab alkalmazható lokálisan előrehaladott vagy áttétet adó hólyagdaganat kezelésére abban az esetben, ha a daganat a ciszplatinkezelés alatt progrediált, illetve olyan betegeknél, akiknél nem alkalmazható platinaalapú kezelés. Jelenleg számos PD-1/PD-L1-gátló I/II. fázis vizsgálat alatt áll, amelyek közül a nivolumab, valamint a durvalumab is ígéretesnek tűnik (9). Az immun-checkpoint-inhibitorok szerepe a jövőben nagy valószínűséggel előtérbe fog kerülni. Számos vizsgálat eredménye azt sugallja, hogy idővel alkalmazásuk teret fog nyerni a nem-izominvazív hólyagdaganatok kezelésében is, valamint az izominvazív daganatok esetén a neoadjuváns kezelésben.
A Semmelweis Egyetem Urológiai Klinikájának Uroonkológiai Centrumában először 2002-ben végeztek adjuváns MVAC-kezelést, amelyet 2008 nyarán az adjuváns GC-kezelés váltott fel. 2018 tavasza óta a platinaalapú kemoterápiás kezelés alatt progressziót mutató, illetve platinára alkalmatlan hólyagrákos betegek pedig checkpoint-inhibitor kezelésben részesülnek. Intézetünkben a kemoterápiás kezelések száma is növekvő tendenciát mutat, amely napjainkra már elérte a 20 beteg/év feletti számot. Jelen vizsgálatunk célja az volt, hogy az elmúlt évek eredményeit összegezve áttekintést nyújtsunk a kemoterápiával kezelt hólyagrákos betegeinkkel kapcsolatos tapasztalatainkról.
Anyag és módszer
2007. augusztus és 2017. november között a Semmelweis Egyetem Urológiai Klinikáján platinaalapú kemoterápiával kezelt hólyagrákos betegek adatait gyűjtöttük össze. Az adott időszakban 146 beteget vizsgáltunk, közülük elemzésünkbe 135 beteget válogattunk be. A kizárások okai között a neoadjuváns, illetve a külső intézetben történő kezelések, valamint a hiányos dokumentációk szerepeltek. A vizsgálat kezdetén kigyűjtöttük a betegek legfontosabb klinikopatológiai adatait valamint a kemoterápiával kapcsolatos adatokat, majd statisztikai elemzéseket végeztünk. Vizsgáltuk a kemoterápia indikációjának, a kemoterápia utáni progresszió típusának, a betegek társbetegségeinek, valamint a radiológiai progresszió túlélésre gyakorolt hatását.
Az egyes klinikai és patológiai paraméterek valamint a betegek túlélése közötti összefüggéseket részletes statisztikai vizsgálatnak vetettük alá, amelyhez az IBM SPSS Software 20.0. verziót használtuk.
Eredmények
A betegcsoport általános jellemzése
A 135 vizsgált betegünk között 38 nő és 97 férfi szerepelt (nő:férfi ≈ 1:2,6). A kezelés időpontjában a betegek átlagéletkora 63 év volt (40–82). A betegek közül 83 fő (61%) 65 éves vagy annál fiatalabb, míg 52 beteg 65 évnél idősebb volt (39%). A vizsgálatba bevont 135 beteg közül 38 fő dohányzott és ugyancsak 38 fő nem dohányzott, míg 59 beteg dohányzási szokásairól nem álltak rendelkezésünkre adatok. A korábban a dohányzásról leszokott betegeket a dohányzó csoport tagjai közé soroltuk. A daganat 5 beteg esetén pT1 (3,9%), 43 betegnél pT2 (33,9%), 47 betegnél pT3 (37%) és 32 betegnél pT4 (25,2%) stádiumot ért el. Leggyakrabban a GC-alapú kemoterápiás kezelést alkalmaztuk (109/135; 81%); ennél ritkábban fordultak elő a gemcitabin-carboplatin (17/135; 13%), valamint az MVAC (9/135; 6%) kezelések. A betegek klinikopatológiai adatait az 1. táblázat mutatja be.
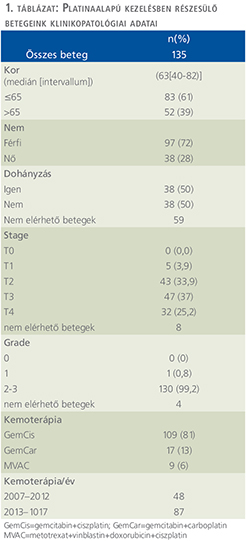
A 135 beteg közül 102-nek volt nem rosszindulatú társbetegsége (76%). Magasvérnyomás-betegség 79 betegnél (59%) fordult elő, diabetes mellitus 22 fő (16%) esetén került leírásra. Szív-ér rendszeri betegség 20 betegnél (15%), míg tüdőbetegség 23 betegnél (17%) volt megfigyelhető. Egyéb urológiai betegség (pl.: benignus prosztata hiperplázia, a funkciós vese, vesekövesség) 4 beteg (3%) anamnézisében szerepelt. További társbetegség (glaukóma, psoriasis, osteoporosis, colitis ulcerosa, krónikus fertőzések) 24 betegnél (18%) fordultak elő (1. ábra).
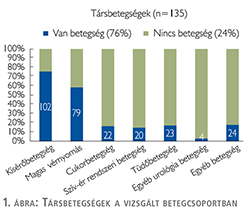
A kemoterápia indikációja szerint három csoportot különböztettünk meg: adjuváns kezelésben részesültek azok, akik a radikális cystectomia szövettani eredménye szerint lokálisan előrehaladott lelettel (pT3/pT4, N0; n=42/135; 31,1%), nyirokcsomóáttéttel (pT1/pT2, N+, n=19/135; 14,1%) vagy mindkettővel (pT3/pT4 és N+, n=28/135; 20,7%) rendelkeztek. Induktív kezelésben részesültek, akiknek a tumora a cystectomia után progrediált (lokális recidíva n=5/135; 3,7%, távoli szervi metasztázis n=7/135; 5,2%, és nyirokcsomóáttét n=1/135; 0,8%). Palliatív kezelésben részesültek azok a betegek, akiknél radikális sebészi kezelésre nem volt lehetőség (n=33/135; 24,4%) (2. ábra).
Intézetünkben a kemoterápiában részesülő betegeink száma 2007–2012 között 48 volt, míg az azt követő 5 évben majdnem duplájára nőtt; 2013–2017 között 87 beteg részesült kemoterápiás kezelésben (1. táblázat).
A platinaalapú kemoterápia indikációjának és a túlélés viszonyának vizsgálata
A kemoterápia indikációja szerint három csoportot különböztethetünk meg:
- adjuváns,
- induktív és
- palliatív.
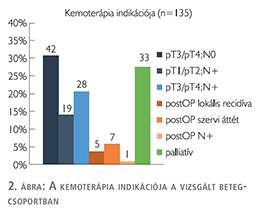
A három csoport közül az induktív terápiában részesülők túlélése volt a legkedvezőtlenebb, ezt követte a palliatív kezelésben részesülők csoportja, míg az adjuváns kezelést kapó betegeknél szignifikánsan jobb túlélés igazolódott (p<0,001). Az adjuváns kezelésben részesülők három csoportja (pT3/pT4, N+, pT3/pT4 és N+) között a túlélés tekintetében nem találtunk különbséget (3. ábra).
A platinaalapú kemoterápia utáni progresszió és a túlélés viszonyának vizsgálata
A kemoterápia után kialakuló progresszió típusa szerint a lokális recidíva és a távoli áttét megjelenése hasonlóan rossz prognózist jelentett, míg a nyirokcsomóáttét megjelenése szignifikánsan jobb prognózissal járt együtt (p=0,036) (4. ábra).

A betegcsoport klinikopatológiai és a túlélés viszonyának vizsgálata
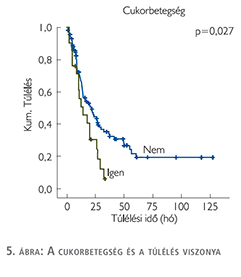
A vizsgált klinikopatológiai paraméterek közül a betegek életkora, neme, dohányzási szokásai, a magas vérnyomás és az obstruktív tüdőbetegség, valamint a kemoterápia típusa (gemcitabin-ciszplatin/carboplatin) nem mutatott összefüggést a túléléssel. Ezzel szemben a cukorbetegség szignifikáns rizikófaktornak bizonyult (p=0,027) (5. ábra).
A radiológiai progresszió és a túlélés viszonyának vizsgálata
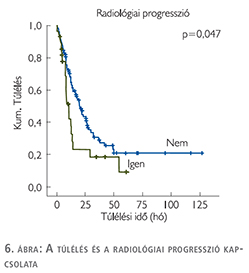
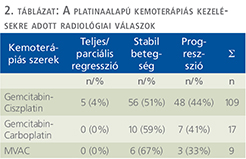
A radiológiai válasz szerint három csoportot hoztunk létre: teljes vagy parciális regressziót mutató, a stabil betegséggel bíró és a progressziót mutató betegek csoportjait. A vizsgált 135 főből 5 betegnél volt megfigyelhető teljes vagy részleges radiológiai válasz, 72 betegnél stabil volt a betegség, míg 58 betegnél progressziót véleményezett a radiológus (2. táblázat). Az adatok további analízise után kiderült, hogy a kemoterápia alatt radiológiai progressziót nem mutató páciensek szignifikánsan hosszabb ideig éltek (p=0,047), mint a képalkotóval igazolt, progressziót mutató betegek (6. ábra).
Megbeszélés
Az izominvazív hólyagdaganatos betegeknél a metasztázisok megjelenése jelenti a legnagyobb veszélyt, amely az esetek körülbelül negyedében fordul elő. A tumor szisztémás terjedésének megelőzésére, illetve megállítására első vonalban a platinaalapú kemoterápia áll rendelkezésünkre. Klinikánkon a mai napig első vonalban a GC kombinációs kezelést alkalmazzuk a progressziót mutató, izominvazív hólyagdaganatos betegeknél, és bár a kemoterápiában részesülő betegek száma – ha csak apró léptékben is – évről évre növekszik, a kezelés sajnos csak a betegek körülbelül felében bizonyul hatékonynak. Amennyiben a daganat a kemoterápia alatt progressziót mutat, úgy másodvonalban a checkpoint-inhibitor terápiára esik a választásunk. A GC-kezelés neoadjuváns alkalmazása egyelőre kevésbé terjedt el, aminek az a fő oka, hogy az 5 éves túlélést a betegek mindössze 5%-ában, míg a 10 éves túlélést 7,5%-ában hosszabbítja meg (10). A legújabb kutatások arra utalnak, hogy azok a betegek, akik nem adnak radiológiai választ a neoadjuváns kezelésre, rövidebb ideig élnek, mint azok, akik azonnali sebészi terápiában részesültek (neoadjuváns kemoterápia nélkül) (10). Mindezek alapján belátható, hogy nagy szükség lenne a ciszplatinkezelés hatékonyságának előrejelzésére. A radikális cystectomiára váró betegek Klinikánkon 2018 tavasza óta részesülnek neoadjuváns kemoterápiában, ám az eddigi alacsony betegszám miatt a neoadjuváns kezeléssel kapcsolatos tapasztalataink egyelőre korlátozottak.
A klinikai gyakorlatban az adjuváns kezelés jobban elterjedt a neoadjuváns kezelésnél. Egy 269 előrehaladott hólyagrákos beteg adatait feldolgozó multicentrikus tanulmány, amely az MVAC és az egykomponensű ciszplatinkezelés hatékonyágát hasonlította össze, egyértelműen az MVAC-kezelést ítélte meg hatékonyabbnak a radiológiai teljes válasz (39% vs. 12%), a progressziómentes túlélés (10 vs. 4 hónap) és a teljes túlélés tekintetében (13 vs. 8 hónap). A legfőbb akadályt azonban MVAC-kombináció kezelés alkalmazásában a gyakran jelentkező és akár igen súlyos mellékhatások jelentették. Mieloszuppresszió, neutropeniás láz, szepszis, mucositis és hányás miatt a betegek 54%-a igényelt hospitalizációt (11). A GC kettős kombináció az egyik leggyakrabban választott elsővonalbeli kemoterápiás kezelés izominvazív hólyagdaganatoknál, amely több tanulmány alapján az MVAC-kezeléssel összehasonlítva megegyező hatékonysággal, ellenben sokkal kevesebb toxikus mellékhatással bír. Egy randomizált, 405 beteget magába foglaló tanulmány alapján az MVAC- és GC-kezelés esetén a teljes válaszarány 49% vs. 47%, a teljes túlélés 14 vs. 15 hónap, az 5 éves túlélés pedig 13% vs. 15% volt. Súlyos mellékhatások azonban ritkábban jelentkeztek GC-kezelés esetén: neutropenia GC-kezeléskor 71%-ban alakult ki, míg MVAC-kezelés esetén a betegek 82%-át érintette. Neutropeniás szepszis 2% vs. 14%-ban, míg mucositis 1% vs. 22%-ban volt megfigyelhető (11). A GC tehát hasonló onkológiai hatás mellett kedvezőbb mellékhatásprofilt mutatott az MVAC-kezeléshez képest, ami a GC alkalmazásának előtérbe kerülését eredményezte.
Az általunk vizsgált betegpopulációban a magasvérnyomás-betegség a betegek 59%-át, míg a cukorbetegség 16%-át érintette. Mindkét idült betegség vesefunkció-csökkenéshez vezethet. Hólyagdaganatos betegeknél maga a malignus betegség is okozhat vesefunkció-csökkenést az obstrukció miatt kialakult hydronephrosis révén. Mivel a ciszplatinalapú kemoterápia csökkent vesefunkcióval rendelkező betegeknek nem adható, így mind az alapbetegség, mind a társbetegségek miatt kiemelten fontos a betegek eGFR-értékének rendszeres ellenőrzése.
A vizsgálatba bevont betegek 81%-a GC-kezelésben, míg gemcitabin-carboplatin és MVAC-kezelésben kevesebb, mint 20% részesült.
Vizsgálataink szerint az induktív terápiában részesülők túlélése kedvezőtlenebb, mint a palliatív kezelésben részesülőké, míg az adjuváns kezelést kapó betegeknek szignifikánsan kedvezőbb a túlélése (p<0,001). Érdekes, hogy az induktív kezelésben részesülők túlélési eredményeit még a palliatív kemoterápiával kezelt betegek túlélése is felülmúlta. Ez azért meglepő, mert a palliatív csoport tagjainál nem került sor radikális cystectomiára, így nagy mennyiségű tumor maradt a betegek szervezetében. Véleményünk szerint talán a palliatív kezelésben részesült betegcsoportban a korábban elkezdett kemoterápia hatott kedvezően a túlélésre. Az irodalomban az induktív, az adjuváns és a palliatív kemoterápiában részesülő hólyagrákos betegek túlélési adatait összehasonlító publikáció idáig nem jelent meg. Az adjuváns kezelésben részesülők három csoportja (pT3/pT4 és N0, pT1/pT2 és N+, pT3/pT4 és N+) között a túlélés tekintetében nem találtunk különbséget.
A kemoterápia után kialakuló progresszió típusa úgy, mint a lokális recidíva és a távoli áttét megjelenése hasonlóan rossz prognózist jelentett, míg a nyirokcsomóáttét megjelenése e két csoporthoz képest szignifikánsan jobb prognózissal járt együtt (p=0,036). Ez az eredményünk egybevág az irodalmi adatokkal: az EAU 2016-ban kiadott irányelve szerint a lokális recidívával rendelkező betegek túlélése 4-8 hónap körül alakul, míg a nyirokcsomó-érintettséggel rendelkező betegcsoport túlélése platinaalapú kemoterápiás kezelés mellett jellemzően 9-26 hónap között mozog (12).
A vizsgált klinikopatológiai paraméterek közül a betegek életkora, neme, dohányzási szokásai, a magasvérnyomás- és az obstruktív tüdőbetegség valamint a kemoterápia típusa (gemcitabin-ciszplatin/carboplatin) nem mutatott összefüggést a túléléssel. Ezzel szemben a cukorbetegség szignifikáns rizikófaktornak bizonyult (p=0,027).
A GC kombinációs kezelésre adott radiológiai választ vizsgálva a betegek 4%-ában mutattak teljes, vagy részleges daganat-regressziót, 51%-ban stabil maradt a betegség, illetve a daganatmentes állapot, míg 44%-ban a radiológiai progresszió alakult ki. Az MVAC kezelésben részesültek 67%-a mutatott terápiás választ (teljes remisszió, parciális remisszió, stabil betegség), míg 33%-ban a daganat progrediált. A GC-kezelésre adott radiológiai válasz irodalmi adatok szerint 49%, amely közelíti saját vizsgálati eredményeinket, az MVAC-kezelés esetén azonban mindössze egy 46%-os válaszarányt említ (13). Ez a csekély eltérés véleményünk szerint a vizsgálatunkban szereplő MVAC-kezelt betegek viszonylag kis száma miatt lehetséges. A radiológiai progressziót mutató betegek túlélése szignifikánsan rosszabb volt szemben azokkal, akik stabil betegséggel rendelkeztek vagy radiológiai választ adtak a platinaalapú kezelésre (p=0,047).
Megemlítendő, hogy a betegek túlélését sok tényező befolyásolja, amelyeket nem tudtunk mind vizsgálni, illetve a beteganyag, bár hazai viszonylatban kiemelkedően nagy elemszámú, ugyanakkor nem elég nagy ahhoz, hogy a betegeket további alcsoportokba soroljuk és részletesebben vizsgáljuk. Ezért is javasolt a jelen vizsgálat folytatása valamint a vizsgált összefüggések megerősítése nagyobb beteganyagon.
A klinikai tapasztalatok és a rendelkezésre álló molekuláris adatok egymástól függetlenül alátámasztják azt az elméletet, miszerint a hólyagdaganatok kialakulásának legalább két egymástól jól elkülönülő útvonala létezik: a papilláris és a nem papilláris út. A felületes hólyagdaganatok nagyrészt a papilláris útvonalon keresztül alakulnak ki, amelyre a fibroblast növekedési faktor receptor 3-as (FGFR3) típusának aktiváló mutációja, a RAS-útvonal aktivációja, vad típusú p53 fehérje és stabil genom a jellemző. A nem papilláris útvonalon kialakult hólyagdaganatok (amely elsősorban az izominvazív hólyagdaganatokat jelenti) jellemzője a p53 és a retinoblastoma-1 fehérjék funkcióvesztéses mutációja, valamint a genetikai instabilitás (14). Az izominvazív daganatok kisebb hányadában megtalálhatók a papilláris útra jellemző molekuláris elváltozások is, ami arra utal, hogy e tumorok a felületes, papilláris daganatokból történő progresszió útján alakulnak ki. Egy friss közlemény szerzői arra a megállapításra jutottak, hogy azok az izominvazív hólyagdaganatok, amelyek papilláris eredetűek (a közleményben „szekunder” tumorok), kevésbé reagálnak a ciszplatin-alapú kezelésre, mint azok a húgyhólyagdaganatok, amelyek már az első diagnózis idején izominfiltráló növekedést mutattak (a közleményben „primer” daganatok) (10). Ez a különbség a kétféle patomechanizmus szerint kialakuló hólyagdaganatok molekuláris hátterére vezethető vissza (15).
Az izominvazív húgyhólyagrákok génexpressziós profil alapján történő molekuláris alcsoportbeosztása két nagy csoportra, az úgynevezett luminális és bazális csoportokra osztotta e daganatokat (16). Az újabb vizsgálatok a luminális alcsoporton belül három további csoportot (luminális papilláris, luminális infiltrált és luminális) írtak le, valamint elkülönítettek egy neuroendokrin-szerű csoportot is (17). Ez utóbbi az izominvazív daganatok csupán 5%-át teszik ki, hisztológiai megjelenését tekintve a többi altípushoz hasonló urotheliális daganat, de molekuláris mintázata alapján neuroendokrin sajátságokat mutat. Az e csoportba tartozó betegek túlélési kilátásai a legrosszabbak az összes alcsoporthoz viszonyítva. A különböző molekuláris altípusokhoz sorolható tumorok egyik fontos klinikai jelentősége abban áll, hogy eltérően reagálnak a különböző kezelésekre. Seiler és munkatársai egy nagy retrospektív vizsgálatban azt találták, hogy a húgyhólyagrák bazális alcsoportja reagál leginkább a neoadjuváns kemoterápiára (18). A luminális infiltrált alcsoport esetében pedig a checkpoint-inhibitor kezelések hatékonyságát valószínűsítik (17).
A húgyhólyagtumoros betegek molekuláris altípusainak meghatározása, és az ez alapján történő személyre szabott kezelés, valamint a klinikai gyakorlatban is megjelenő újabb immunterápiás kezelési lehetőségek növekedése hozzásegíthet egy árnyaltabb, és ez által hatékonyabb terápiás algoritmus kidolgozásához. Ehhez azonban szükség van a hólyagtumorok molekuláris sajátságait is figyelembe vevő predikciós módszerek tökéletesítésére.
Támogatás
E munka a Magyar Urológus Társaság, az NKFIH/FK 12443, NVKP 16-1-2016-004 és az Emberi Erőforrások Minisztériuma ÚNKP-18-4-SE-66 Kódszámú Új Nemzeti Kiválóság Programjának Támogatásával készült. Dr. Szarvas Tibor a Magyar Tudományos Akadémia Bolyai János ösztöndíjában részesült.
References
1. Alsudani MMA. Historical development of diagnosis and treatment of bladder cancer. Eur Urol Suppl 2013; 12: e39.
2. Chang SS, Bochner BH, Chou R, Dreicer R, et al. Treatment of Non-Metastatic Muscle-Invasive Bladder Cancer: AUA/ASCO/ASTRO/SUO Guideline. J Urol 2017; 198(3): 552–559. https://doi.org/10.1016/j.juro.2017.04.086
3. Mandal A. History of Chemotherapy. 2018; Available from: https://www.news-medical.net/health/History-of-Chemotherapy.aspx
4. Dasari S, Tchounwou PB. Cisplatin in cancer therapy: molecular mechanisms of action. Eur J Pharmacol 2014; 740: 364–78. https://doi.org/10.1016/j.ejphar.2014.07.025
5. Trenta P, Calabro F, Cerbone L, Sternberg CN. Chemotherapy for Muscle-Invasive Bladder Cancer. Curr Treat Options Oncol 2016; 17(1): 6.
6. Derek Raghavan M. Neoadjuvant treatment options for muscle-invasive urothelial bladder cancer. https://www.uptodate.com, 2018.
7. von der Maase H, Sengelov L, Roberts JT, Ricci S, Dogliotti L, Oliver T, Moore MJ, Zimmermann A, Arning M. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol 2005; 23(21): 4602–8.
8. Bellmunt J, Powles T, Vogelzang NJ. A review on the evolution of PD-1/PD-L1 immunotherapy for bladder cancer: The future is now. Cancer Treat Rev 2017; 54: 58–67. https://doi.org/10.1016/j.ctrv.2017.01.007
9. Rouanne M, Roumiguie M, Houede N, Masson-Lecomte A, et al. Development of immunotherapy in bladder cancer: present and future on targeting PD(L)1 and CTLA-4 pathways. World J Urol 2018. 36(11): 1727–1740. https://doi.org/10.1007/s00345-018-2332-5
10. Pietzak EJ, Zabor EC, Bagrodia A Armenia J, et al. Genomic Differences Between “Primary” and “Secondary” Muscle-invasive Bladder Cancer as a Basis for Disparate Outcomes to Cisplatin-based Neoadjuvant Chemotherapy. Eur Urol 2018.
11. Joaquim Bellmunt M. Treatment of metastatic urothelial cancer of the bladder and urinary tract. https://www.uptodate.com, 2018.
12. Bokarica P, Hrkac A, Gilja I. Re: J. Alfred Witjes, Thierry Lebret, Eva M. Comperat, et al. Updated 2016 EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer. Eur Urol 2017; 71: 462–75. Eur Urol 2017; 72(2): e45.
13. Alfred Witjes J, Lebret T, Comperat EM, Cowan NC, et al. Updated 2016 EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer. Eur Urol 2017; 71(3): 462–475. https://doi.org/10.1016/j.eururo.2016.06.020
14. Choi W, Ochoa A, McConkey DJ, et al. Genetic Alterations in the Molecular Subtypes of Bladder Cancer: Illustration in the Cancer Genome Atlas Dataset. Eur Urol 2017; 72(3): 354–365. https://doi.org/10.1016/j.eururo.2017.03.010
15. Tibor Szarvas CO, Henning Reis. Neoadjuvant cisplatin-based chemotherapy in “primary” and “secondary” muscle-invasive bladder cancer – is it a surrogate for molecular subtypes? Translational Cancer Research, 2019.
16. Damrauer JS, Hoadley KA, Chism DD, Fan C, et al. Intrinsic subtypes of high-grade bladder cancer reflect the hallmarks of breast cancer biology. Proc Natl Acad Sci U S A 2014; 111(8): 3110–5. https://doi.org/10.1073/pnas.1318376111
17. Robertson AG, Kim J, Al-Ahmadie H, Bellmunt J, et al. Comprehensive Molecular Characterization of Muscle-Invasive Bladder Cancer. Cell 2018; 174(4): 1033.
18. Seiler R, Gibb EA, Wang NQ, Oo HZ, et al. Black, Divergent Biological Response to Neoadjuvant Chemotherapy in Muscle-invasive Bladder Cancer. Clin Cancer Res 2018.