Tumour in the renal graft after transplantation
DOI: 10.22591/magyurol.2019.3.kissz.98
Authors:
Kiss Zoltán dr., Berczi Csaba dr., Berczi Adrienne, Flaskó Tibor dr.
Debreceni Egyetem Általános Orvostudományi Kar, Urológiai Tanszék, Debrecen (igazgató: Flaskó Tibor dr.)
Summary
Introduction: The administered immunosuppressive treatment increases the incidence of malignant tumours after organ transplantation. Occurrence of renal cancers is higher after kidney transplantation than in normal population. These tumours mainly occur in the own kidney of the recipients, while in 10% they developed in the graft. The authors report their experience with treatment of tumour in renal graft in their three cases.
Case presentation: Case 1: Kidney transplantation was performed 20 years ago in a 46-year-old male patient. The routine ultrasound examination showed a 2 cm tumour in the graft which was confirmed by the abdominal MR scan. The patient underwent partial nephrectomy. Histology proved pT1a, renocellular carcinoma. The dose of immunosuppressive drugs was reduced after surgery. No recurrence was observed in the 2-year follow-up period.
Case 2: Renal transplantation was done 13 years ago in a 65-year-old female patient. Ultrasound and CT scan of the graft described a 35 mm tumour at the upper pole of the kidney. Partial nephrectomy was performed. Histological examination showed pT1a, renocellular carcinoma. Following surgery, the dose of immunosuppressive drugs was reduced. There was no tumour recurrence during the 17 months’ follow-up.
Case 3: In the 62-year-old male patient, kidney transplantation was carried out 10 years earlier. During the follow-up, the ultrasound showed a 2.5 cm tumour in the graft, which was confirmed by CT. Partial resection was performed and a multifocal tumour was removed. The histology proved papillary carcinoma. Following surgery, everolimus treatment was started instead of tacrolimus. There was no tumor recurrence during the 2 months follow-up.
Discussion: After kidney transplantation, in case with tumour in the renal graft organ sparing surgery is recommended. In the described cases, tumour resection was also performed. The organ sparing surgery provides adequate oncological efficacy with preservation the function of the transplanted kidney.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Bevezetés: A szervtranszplantációt követően alkalmazott immunszuppresszív kezelés növeli a malignus daganatok incidenciáját. Vesetranszplantációt követően a vesetumor előfordulása magasabb, mint a normálpopulációban. Ezen daganatok többsége a beteg saját veséjében alakul ki, azonban 10%-uk a graftban jelentkezik. Szerzők tanulmányukban három eset kapcsán ismertetik a transzplantált vesében jelentkező vesedaganat kezelésével szerzett tapasztalataikat.
Esetismertetés: 1. eset: a 46 éves férfi betegnél 20 évvel korábban történt vesetranszplantáció. A gondozás során rutinszerűen végzett ultrahangvizsgálat egy 2 cm-es tumort észlelt a graftban, amelyet az elvégzett hasi MR-vizsgálat megerősített. A betegnél parciális nephrectomiát végeztek. A szövettani vizsgálat pT1a, renocelluláris karcinómát igazolt. A műtétet követően az immunszuppresszív gyógyszerek dózisát csökkentették. A 2 éves utánkövetés során recidív tumort nem észleltek.
2. eset: a 65 éves nőbetegnél 13 évvel ezelőtt végeztek vesetranszplantációt. Ultrahang- és CT-vizsgálat a transzplantált vese felső pólusában egy 35 mm-es daganatot írt le, amely miatt vesereszekció történt. A szövettani vizsgálat pT1a, renocelluláris karcinómát mutatott. A műtétet követően az immunszuppresszív gyógyszerek dózisát csökkentették. A17 hónapos utánkövetés alatt recidíva nem alakult ki.
3. eset: a 62 éves férfi betegben 10 évvel korábban vesetranszplantáció történt. Az utánkövetés során az ultrahangvizsgálat a graftban 2,5 cm-es tumort mutatott, amelyet a CT is igazolt. Tumorreszekció történt, amelynek során multifokális daganat került eltávolításra. A szövettan papilláris karcinómát véleményezett. A műtétet követően a tacrolimus helyett everolimus kezelés indult. A 2 hónapos utánkövetés alatt recidíva nem jelentkezett.
Megbeszélés: A vesetranszplantációt követően a graftban kialakult vesetumorok esetében szervmegtartó műtétet ajánlott végezni. Az ismertetésre került esetekben is tumorreszekció történt. A szervmegtartó műtét megfelelő onkológiai eredményességet biztosított az átültetett vese funkciójának megtartása mellett.
Bevezetés
A vesesejtes karcinóma a malignus daganatok 2-3%-át alkotja. Világszerte évente kb. 209 000 új esetet regisztrálnak, míg a daganat okozta mortalitás mértéke 102 000/év. Az elmúlt két évtized során 2%-kal nőtt tovább az incidenciája világszerte. A férfiakban a vesesejtes karcinóma a hetedik, míg a nőkben a kilencedik leggyakoribb daganatos megbetegedés (1, 2).
A vesedaganat pontos oka nem ismert. Az etiológiai faktorok közé tartozik a dohányzás, az elhízás és a magasvérnyomás-betegség. Az irodalmi adatok alapján a vesetumor előfordulása gyakoribb végstádiumú veseelégtelenségben szenvedőknél és a szerzett vesecisztás betegeknél mint az átlagos populációban. A világos sejtes vesedaganatok körübelül 5%-ban örökletes és genetikai rendellenességekkel társulnak (1, 3).
A végstádiumú krónikus vesebetegek kezelésére alkalmazott veseátültetést követően a betegek immunszuppresszív kezelést kapnak, aminek célja az átültetett szerv rejekciójának megelőzése és kezelése. Az immunszuppresszió következtében az immunrendszer ellenállóképessége csökken, ezért a szervezet fogékonyabb fertőzésekkel szemben, és ugyanakkor az immunszuppresszív kezelés mellett megnő a daganatos megbetegedések aránya, különösen a lymphomák előfordulása (4, 5).
Tanulmányunkban a vesetransplantációt követőn a graftban kialakult daganat kezelésével szerzett tapasztalatainkat mutatjuk be.
Esetismertetés
1. eset
A beteg korábbi anamnézisében ismeretlen okból fennálló krónikus veseelégtelenség szerepel, mely miatt 1995-ben, az akkor 25 éves férfibetegben hemodialízis kezelést indítottak.
1996. szeptemberben a beteg – 26 éves korában – kadáver vesetranszplantációban részesült. A transzplantációt követően immunszuppresszív kezelést kapott, amely szteroidot, tacrolimust és mikofenolát-mofetilt tartalmazott.
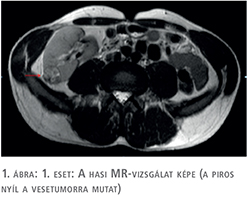
2016. júniusban a rutinszerűen végzett kontroll UH-vizsgálat a graftban kis daganatot írt le. Az ezt követően elvégzett MRI-vizsgálat a transzplantált vesében 2 cm-es tumort igazolt (1. ábra). Távoli áttét, illetve nyirokcsomó-metasztázis nem volt kimutatható.
2016 szeptemberében – a beteg 46 éves korában, 20 évvel a vesetranszplantációt követően – a graftból tumorreszekció történt (2. ábra). A műtét során a hilus lefogási idő 10 perc volt, a reszekciós alap zárásához 2/0-ás Safil varróanyagot és Bloodcare hálót alkalmaztunk. A szövettani vizsgálat világossejtes karcinómát igazolt (pT1a) negatív sebészi széllel. A daganat szövettani differenciáltsága Fuhrman grade 3 volt.
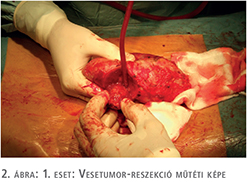
A tumoreltávolítást követően a az immunszuppresszív kezelés dózisát csökkentették. A beteg ezt követően 5 mg/nap tacrolimust kapott.
A beteg csaknem 2 éves utánkövetése során tumorkiújulás nem jelentkezett.
2. eset
Távolabbi anamnézisében magas vérnyomás szerepel. Ismeretlen okból fennálló krónikus veseelégtelensége miatt az akkor 48 éves nőbeteg 1999-ben krónikus hemodialízis programba került.
A betegben 2003-ban – 65 éves korában – kadáver vese allotranszplantációját végezték. Ezt követően szteroidot, tacrolimust és mikofenolát-mofetilt tartalmazó immunszuppresszív kezelést kapott.
2016. szeptemberben az utánkövetés a beteg gondozása során végzett UH-vizsgálat az átültetett vesében 3 cm-es tumorgyanús képletet talált. Ezt követően CT-vizsgálat történt, amely a graft felső pólusában 3,5 cm-es daganatot igazolt.
2016. decemberben a graftban elhelyezkedő vesetumora miatt tumorreszekció történt (3. ábra). A műtét során a hiluslefogási idő 12 perc volt, a reszekciós alap zárásához 2/0-ás Safil varróanyagot és Bloodcare hálót alkalmaztunk. A hisztológiai vizsgálat világossejtes vesekarcinómát mutatott (pT1a), amelynek szövettani diffrenciáltsága Fuhrman grade 2 volt. A sebészi szél negatív volt. A műtétet követően az immunszuppresszív kezelés dózisát csökkentették, s így a továbbiakban 1 mg/nap tacrolimust kapott.
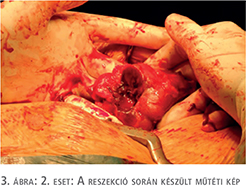
A 17 hónapos utánkövetés alatt recidíva nem alakult ki.
3. eset
Korábbi anamnézisében hasfali sérvműtét és appendectomia szerepel. 2003 óta ismert fokális segmentalis glomerulosclerosisa, amelynek progressziója miatt 2006-tól hemodialízis kezelés alatt állt. Az akkor 52 éves férfi betegben, 2009. januárban kadáver vesetranszplantációja történt. Ezt követően tacrolimus, szteroid és mikofenolát-mofetil tartalmú immunszuppresszív kezelést kapott. 2018. novemberben a kontroll UH-vizsgálat a graftban tumorgyanús képletet észlelt, amely miatt CT-vizsgálat történt, s ez 2,5 cm-es daganatot véleményezett. Vesebiopsziát végeztünk s ennek szövettana renocelluláris karcinómát igazolt. Ezt követően 2019. 03-ban a graftból tumorreszekciót végeztünk (4. ábra). A műtét során multifokális tumort találtunk, amelyet reszekáltunk. A műtét során a hiluslefogási idő 14 perc volt, a reszekciós alap zárásához 2/0-ás Safil varróanyagot és Bloodcare hálót alkalmaztunk. A szövettan multifokális papilláris vesekarcinómákat (grade 2) mutatott negatív sebészi széllel. A műtétet követően a tacrolimus helyett everolimus kezelés indult. Ezen betegnél egyelőre 2 hónapos utánkövetésről tudunk beszámolni.
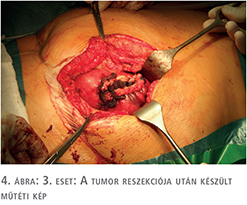
Megbeszélés
A végstádiumú krónikus vesebetegségek kezelésére az elsődlegesen javasolt eljárás a vesetranszplantáció, mert ezáltal a betegek élettartama meghosszabbodik és életminőségük javul a dialízis kezelésekhez viszonyítva (6, 7). A transzplantáció során a betegbe „idegen” szerv kerül beültetésre, s ilyenkor a beteg saját immunrendszere aktiválódik a beültetett szerv ellen. A szervtranszplantáció során az immunszuppresszív kezelés csökkenti az akut rejekció gyakoriságát és növeli a graft túlélését, azonban több lényeges szövődményt okozhat. Így emelkedik a kardiovaszkuláris betegségek, a különböző fertőzések, valamint a malignus betegségek előfordulási gyakorisága (8).
A transzplantációt követően kialakuló malignus daganatokkal kapcsolatban elsősorban az alkalmazott immunszuppresszív kezelést tekintik rizikótényezőnek (9, 10). Több adat arra utal, hogy egyes immunszuppresszív készítményeknek direkt onkogenetikus hatása lehet. Ezt a lehetőséget az azathioprinnal, a cyclosporinnal és a tacrolimussal kapcsolatban vetették fel. Míg napjainkban az azathioprint ritkán, addig a cyclosporint és a tacrolimust elterjedten használják a veseátültetést követőn alkalmazott kezelés során, így ezek jelentősége nagyobb. A cyclosporin és a tacrolimus calcineurin-inhibitorok és az eddigi adatok szerint azáltal idézhetik elő a daganatnövekedést, hogy növelik a bTGF (transforming growth factor) és VEGF (vascularis endothelialis growth factor) szintet (9, 11, 12). Ugyanakkor vannak olyan adatok is, amely szerint sem az alkalmazott immunszuppresszív kezelés típusának, sem annak időtartamának nincs szignifikáns hatása az urológiai daganatok kialakulására (13). Megemlítendő azonban, hogy mTOR-receptor-gátló készítményeket alkalmazhatnak a transzplantáció után az immunszuppresszív kezelés részeként is, valamint a metasztatikus vesedaganatok terápiája alkalmával is.
Nem szabad figyelmen kívül hagyni, hogy egyéb tényezők is szerepet játszhatnak a daganat kialakulásában. Az eddigi adatok alapján a vesetranszplantációt követően kialakuló tumorok multifaktoriális eredetűek. Az immunszuppresszív kezelés mellett egyéb okok is jelen lehetnek, így bizonyos környezeti tényezők, elhízás, dohányzás, fájdalomcsillapítók hosszantartó használata, genetikai tényezők és szerzett cisztás betegségek szintén rizikótényezőknek tekinthetőek ebben a populációban (14).
Már régóta ismert, hogy a hemodialízis kezelésben részesülő krónikus veseelégtelenségben szenvedő betegekben lényegesen gyakoribb a vesetumor, mint a normális populációban (13,15,16).
Az irodalmi adatok alapján a vesetranszplantáció után az újonnan kialakuló rosszindulatú daganatok 7-11%-ban fordulnak elő (17, 18). Ez négy-ötszöröse a normális populációban észlelt incidenciához képest (7, 18). A vesetranszplantáció után kialakult tumorok 0,4-5,5%-a urológiai daganat. Ezek közül leggyakoribb a vesedaganat, amelynek előfordulása 15× gyakoribb, mint az átlagpopulációban (13, 19–22).
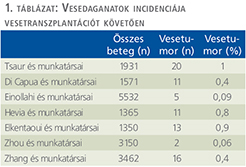
A vesedagatok incidencája a vesetranszplantáció után kevesebb, mint 1% (1. táblázat) (18, 19–24).
Figyelembe véve, hogy a transzplantációt követően a malignus betegségek előfordulása gyakoribb, ezért a veseátültetett betegek utánkövetése, gondozása során vizsgálatokat kell végezni az esetlegesen kialakuló daganatok szűrése irányában is (25–27). Ez a vesedaganatok szempontjából elsődlegesen a kontroll UH-vizsgálatokat jelenti. A rutinszerűen végzett UH-vizsgálatoknak köszönhetően a vesedaganat még korai stádiumban kerülhet felismerésre, amely kuratív kezelést tesz lehetővé és ezáltal a beteg életkilátásait javítja.
A vesetranszplantációt követően kialakuló vesedaganatok döntő többsége a beteg eredeti, saját veséjében fordul elő, s csak az esetek kb. 10%-ában jelentkezik a graftban (22, 28). Ploussard és munkatársai a közleményükben úgy találták, hogy a 2396 transzplantált betegükből 12 esetben találtak a graftban daganatot. A transzplantációtól a tumor kialakulásáig átlagosan 13 év telt el, így annak lehetősége, hogy a daganat a donorból került átvitelre, kizárható volt.
Amennyiben a vesedaganat a beteg eredeti, saját veséjében van, úgy radikális nephrectomia végzése javasolt, a daganat nagyságától függetlenül, hiszen itt már nem funkcionáló veséről van szó.
Azokban az esetekben viszont, amikor a daganat a graftban alakul ki, lehetőség szerint szervmegtartó műtét végzésére kell törekedni. Természetesen ennek kapcsán figyelembe kell venni a tumor nagyságát és a grafton belüli elhelyezkedését is (26, 28, 29). Amennyiben a parciális nephrectomia nem megvalósítható, úgy a graftot el kell távolítani és ezt követően a beteg majd dialízis kezelésre kerül. A graftban elhelyezkedő tumor esetén ritkán radiofrekvenciás vagy krioteraterápia elvégzésére is sor kerülhet. Ez akkor jöhet szóba, ha a betegnek súlyos társult betegségei vannak vagy az anaesztézia kockázata magas, illetve a beteg visszautasítja a műtétet.
Antunes és munkatársai 2897 vesetranszplantációt követően 58 esetben észleltek urológiai daganatot a betegek gondozása során. Az urológiai tumorok közül a leggyakoribb a prosztatadaganat, míg a második leggyakoribb a vesekarcinóma, amelynek incidenciája 0,8% volt. Anyagukban 23 recipiensben összesen 25 tumort észleltek. Egy betegnek szinkron, míg egy másik recipiensnek metakron vesedaganata volt. A vesekarcinóma 22 alkalommal a beteg saját veséjében, míg 3 esetben (12%) a graftban alakult ki. A daganatokat a recipiensek követése során végzett rutin UH-vizsgálatok során diagnosztizálták. A vesedaganatok 76%-a volt kisméretű vesedaganat („small renal mass”). A vesetranszplantációtól a vesetumor diagnózisáig eltelt idő átlagosan 54 hónap volt. A beteg saját, nem működő veséjében kialakult daganatoknál valamennyi esetben radikális nephrectomiát, míg a graftban levő tumorok esetében vesetumor-reszekciót végeztek. A szerzők nem közölték, hogy az immunszuppresszív kezelést csökkentették-e a daganat diagnosztizálását követően. Az 5 és 10 éves általános túlélés 81,3% és 87% volt. Vesedaganat okozta mortalitás egy betegben fordult elő (13).
Saját eseteinkben a graftban kialakult vesedaganat incidenciája 0,23% volt. Mindhárom betegben a gondozás, utánkövetés során végzett UH-vizsgálalat diagnosztizálta a tumor jelenlétét. Tekintettel arra, hogy a daganatok korai stádiumban lettek kimutatva, mindegyik betegben tumorreszekció történt a graftból. A szervmegtartó műtét megfelelő onkológiai eredményességet biztosított a graft működésének megőrzése mellett. Ugyanakkor a rövid utánkövetési idő miatt a bemutatott betegeknél a hosszú távú túlélést még nem tudjuk megítélni.
References
1. Brian I Rini, Steven C Campbell, Bernard Escudier, Renal cell carcinoma. Lancet 2009; 373: 1119–32.
2. Lindblad, P. Epidemiology of renal cell carcinoma. Scand J Surg 2004; 93: 88.
3. Bergström A, Hsieh CC, Lindblad P, Lu CM, Cook NR, Wolk A. Obesity and renal cell cancer – a quantitative review. Br J Cancer 2001; 85: 984.
4. Bamoulid J, Staeck O, Halleck F, Khadzhynov D, Paliege A, Brakemeier S, et al. Immunosuppression and Results in Renal Transplantation. Eur Urol Suppl 2016; 15: 415.
5. Leas BF, Uhl S, Sawinski DL, Trofe-Clark J, Tuteja S, Kaczmarek JL, et al. Calcineurin Inhibitors for Renal Transplant 2016. Rockville (MD).
6. Tsaur I, Obermu¨ller N, Jonas D, et al. De novo renal cell carcinoma of native and graft kidneys in renal transplant recipients. BJUI 2010; 108: 229–234.
7. Au E, Wong G, Chapman JR. Cancer in kidney transplant recipients Nat Rev Nephrol 2018; 14(8): 508–520.
8. Veroux M, Puliatti C, Fiamingo P et al. Early de novo malignancies after kidney transplantation. Transplant Proc 2004; 36: 718–720.
9. Hall EC, Pfeiffer RM, Segev DL, Engels EA. Cumulative incidence of cancer after solid organ transplantation. Cancer 2013; 119: 2300–82.
10. Morath C, Mueller M, Goldschmidt H, Schwenger V, Opelz G, Zeier M. Malignancy in renal transplantation. J Am Soc Nephrol 2004; 15: 1582e8
11. Elkentaoui H, Robert G, Pasticier G, Bernhard JC, Couzi L, Merville P, et al. Therapeutic management of de novo urological malignancy in renal transplant recipients: the experience of the French Department of Urology and Kidney Transplantationfrom Bordeaux. Urology 2010; 75: 126–32.39.
12. Hojo M, Morimoto T, Maluccio M, et al. Cyclosporine induces cancer progression by a cell-autonomous mechanism. Nature1999; 397:
13. Antunes H, Tavares-da-Silva E, Oliveira R, Carvalho J, Parada B, Bastos C, et al. De Novo Urologic Malignancies in Renal Transplant Recipients. Transplant Proc 2018; 50(5): 1348–1354.
14. Alexander MP, Farag YM, Mittal BV, Rennke HG, Tullius SG, Singh AK. De novo multifocal renal cell carcinoma in the renal allo-graft. Kidney Int 2009; 75: 111–4.6.
15. Neuzillet Y, Tillou X, Mathieu R, et al. Renal cell carcinoma (RCC) in patients with end-stage renal disease exhibits many favourable clinical, pathologic, and outcome features compared with RCC in the general population. Eur Urol 2011; 60: 366e73.
16. Breda A, Luccarelli G, Rodriguez-Faba O, et al. Clinical and pathological outcomes of renal cell carcinoma (RCC) in native kidneys of patients with end-stage renal disease: a long-term comparative retrospective study with RCC diagnosed in the general population. World J Urol 2015; 33: 1e7.
17. Vajdic CM, McDonald SP, McCredie MRE, et al. Cancer incidence before and after kidney transplantation. JAMA 2006; 296: 2823e31
18. Elkentaoui H, Robert G, Pasticier G, et al. Therapeutic management of de novo urological malignancy in renal transplant recipients: the experience of the French Department of Urology and Kidney Transplantation from Bordeaux. Urology 2010; 75: 126e32
19. di Capua Sacoto C, Luján Marco S, Bahilo Mateu P, Budía Alba A, Pontones Moreno JL, Jiménez Cruz JF. [De novo urological neoplasms in kidney transplant patients: experience in 1,751 patients]. Actas Urol españolas 2010; 34: 88e94.
20. Einollahi B, Simforoosh N, Lessan-Pezeshki M, et al. Genitourinary tumor following kidney transplantation: a multicenter study. Transplant Proc 2009; 41: 2848e9.
21. Zhou M, Zhu Y, Wang L, Wang Y, Fu S, Min Z. Urological malignancy as a complication of renal transplantation: a report of twelve clinical cases. Clin Transpl 2006; 395e8
22. Tsaur I, Karalis A, Probst M, Blaheta RA, Scheuermann EH, Gossmann J, et al. Development of urological cancers in renal transplant recipients: 30-year experience at the Frankfurt Transplant Center. Cancer Sci 2010; 101: 2430–5.3.
23. Zhang J, Ma L, Xie Z, Guo Y, Sun W, Zhang L. Epidemiology of post-transplant malignancy in Chinese renal transplant recipients: a single-center experience and literature review. Med Oncol 2014; 31(7): 32.
24. Hevia V, Gomez V, Diez Nicolas V, Alvarez S, Gomez del CanizoC, Galeano C et al. Development of urologic de novo malig-nancies after renal transplantation. Transplant Proc 2014; 46: 170–5.10.
25. Bennett WM, Simonicha EL, Garrea AM, McEvoya KM, Farinolab MA, Batiuk TD. Renal Cell Carcinoma in Renal Transplantation: The Case for Surveillance. Transplant Proc 2017; 49(8): 1779–1782.
26. Wong G, Chapman JR, Craig JC. Cancer screening in renal transplant recipients: what is the evidence? Clin J Am Soc Nephrol 2008; 3: S87e100.
27. Chiang TJ, Chu SH, Liu KL, Lai WJ, Wang HH, Chen HW, et al. Kidney ultrasound is useful tool in post-transplant follow-up. Transplant Proc 2006; 38: 2018e9.
28. Frascà GM, Sandrini S, Cosmai L, Porta C, Asch W, Santoni M, et al. Renal cancer in kidney transplanted patients. J Nephrol 2015; 28(6): 659–68.
29. Ribal MJ, Rodriguez F, Musquera M, Segarra J, Guirado L, Villa-vicencio H et al. Nephron-sparing surgery for renal tumor: a choice of treatment in an allograft kidney. Transplant Proc 2006; 38: 1359–62.19