Biofilm formation on the surfaces of ureter stents
DOI: 10.22591/magyurol.2020.3.szellt.91
Authors:
Széll Tamás dr.1, Köves Béla dr.2, Tenke Péter dr.2, Nyirády Péter dr.1
1Semmelweis Egyetem, Általános Orvostudományi Kar, Urológiai Klinika, Budapest (igazgató: Nyirády Péter dr.)
2Jahn Ferenc Dél-pesti Kórház, Urológiai Osztály, Budapest (osztályvezető: Tenke Péter dr.)
Summary
It belongs to the urological daily practice to insert ureter stent, in order to maintain the patency of the upper urinary tract. As every foreign body, which is inserted in the human organism, ureter stent is exposed to bacterial colonisation and thus biofilm formation as well. On the surface of ureter stent forming biofilm can induce sequence of complications which can cause the encrustation of stent at the end. The range of these complications can vary from irritative symptoms to life-threatening conditions which make necessary premature change of stent, causing risk and further health burden for the patients. For the purpose of preventing biofilm formation on the surface of ureter stent, extensive researches were conducted and were born some solutions which battle against biofilm with different efficiency. The fight against biofilm is not new-fangled but is timely nowadays as well. In our review we would like to present an overview about the biofilm formation on the surface of ureter stent and the possible treatment strategies against biofilm.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 32. ÉVFOLYAM, 3. SZÁM
Összefoglalás
Az urológiai gyakorlatban mindennaposnak számít a felső húgyutak átjárhatóságának fenntartása érdekében felhelyezett húgyvezetékstent. Mint minden idegen test, amelyet emberi szervezetbe ültetünk, bakteriális kolonizációnak és ezáltal biofilmképződésnek van kitéve. A húgyvezetékstent felületén kialakuló biofilm további szövődmények lavináját indítja el, amely végső soron a stent elkövesedését okozza. Mindezen szövődmények skálája a kellemetlen tünetektől az egészen veszélyes állapotig terjedhet, amely a stent idő előtti cseréjét teszi szükségessé további kockázatot és megterhelést jelentve a páciensnek. A húgyvezetékstent felületén képződő biofilm megakadályozása végett kiterjedt vizsgálatok történtek és született számos megoldás, amelyek eltérő hatékonysággal veszik fel a küzdelmet. A biofilm elleni harc nem új keletű, azonban mind a mai napig időszerű. Összefoglaló közleményünkben a biofilmképződés folyamatáról és a húgyvezetékstent felületén végbemenő, biofilm elleni kezelés lehetséges stratégiájáról szeretnék áttekintést nyújtani.
Bevezetés
Felső húgyúti obstrukció esetén húgyvezetékstent felhelyezése áthidaló megoldásként szolgál a felső húgyút átjárhatóságának fenntartásában, ezáltal a vizelet akadálytalan elvezetésében. 1967 óta – mikor Zimskind és munkatársa közölték tapasztalataikat endoszkópos úton behelyezett tartós szilikon-húgyvezeték stenttel kapcsolatosan – az uréterstentek alkalmazása széleskörűen elterjedt a felső húgyutak átjárhatóságának minimál invazív módon való fenntartásában (1).
Jelentőségénél fogva a biofilmképződés intenzíven kutatott terület az urológiában (2). Húgyvezetékstent viselésekor biofilm képződik a stent belső és külső felületén egyaránt, amely végső esetben a stent részleges vagy teljes elzáródásához vezethet. Biofilm okozta szövődményként nemcsak a stent elzáródása és ennek következtében kialakuló ismételt felső húgyúti obstrukció róható fel, hanem alsó húgyúti tünetegyüttes (dysuria, késztetéses és sürgető vizelési inger, inkontinencia), véres vizelet, visszatérő húgyúti gyulladás is (3, 4). Biofilm által bevont stenttel összefüggésben jelentkező helyi tünetek gyógyszeresen ugyan csillapíthatóak (pl. fájdalomcsillapító, a1-receptor-gátló, antimuszkarin), de hatékonyságuk korlátozott (5, 6, 7, 8). Biofilmmel borított, elkövesedett és elzáródott uréterstent (1. ábra) idő előtti cseréjüket teszik szükségessé, amely a szövődményes esetek mellett az egészségügyi kiadások növekedését is maga után vonja (9). A stentek felületén végbemenő bakteriális kolonizációt, biofilmképződést szemünk előtt kell tartani, annak gyakorisága miatt. Egyes szerzők (Riedl és munkatársa) szoros összefüggést találtak a stent viselésének időtartama és a bakteriális kolonizáció között: tartós stentviselés esetén 100%-ban jelentkezik bakteriális kolonizáció (átlagos időtartam: 39,5 nap), míg átmeneti stentviselés esetén 69,3%-ban (átlagos időtartam: 11,2 nap) (10). Farsi és munkatársa által közölt adatok megerősítik az előző eredményeket: <1 hónap stentviselés esetén 58,6% a bakteriális kolonizáció aránya, >3 hónap stentviselés esetén ez az arány 75,1% (11).

A biofilmmel borított, elkövesedett uréterstentek kérdésével és annak megoldási lehetőségeivel számos vizsgálat foglalkozott már. Ígéretes koncepciók születtek, habár az urológiai gyakorlatban nem honosodtak meg széles körben. Nem tudnak minden tekintetben eleget tenni a velük szemben támasztott összes követelménynek, számottevő klinikai hatékonyságot nem tudtak felmutatni és előállítási költségük magas (7, 12, 13).
A biofilm vizsgálata, képződésének megakadályozása érdekében tett vizsgálatok és erőfeszítések nem újkeletűek, azonban mindezidáig nem sikerült egyetlen olyan megoldást találni, amely önmagában képes lenne az igen szerteágazó összetételű biofilmmel és kóroki tényezőkkel szemben hatékonyan fellépni.
Megbeszélés
Biofilm és képződésének folyamata
A biofilmképződés behatóan vizsgált terület az orvostudományban, mert jelentős szerepet játszik számos fertőzéssel járó kórállapotban. A biofilm nemcsak az urológiában játszik meghatározó szerepet, hanem más orvosi területen is, ahol idegen test emberi szövettel kerül kapcsolatba. Ezen okból adódóan fontos, hogy megértsük a biofilm hátterében álló okokat és kialakulásának folyamatát.
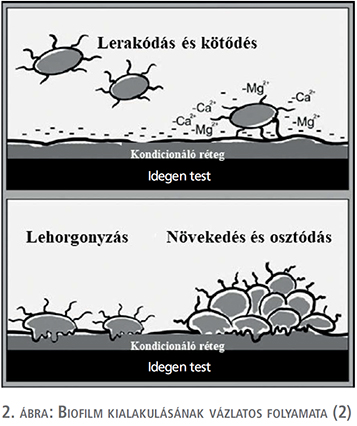
A biofilmet mikroorganizmusok és azok extracelluláris termékeinek felhalmozódásaként határozhatjuk meg, amelyek strukturált közösséget alkotnak valamely felületen (2, 14, 15). Korábbi vizsgálatok kimutatták, hogy néhány alapvető tényező meghatározza a baktériumok adhézióját az idegen testhez: idegen test felületének tulajdonságai, baktériumvirulencia faktorai és a mindenkori környezet, amely körülveszi az idegen testet és a baktériumokat (pl. vizelet-összetétel, pH, húgyúti kövesség) (2, 13, 15, 17). A teljes biofilmképződés egy lépésről lépésre zajló folyamat, amely során 3 fő állomást tudunk megjelölni (2. ábra). Az első lépés a kondicionáló vagy lehorgonyzó réteg kialakulása az idegen test felületén, amely a vizelet szervetlen alkotóelemeiből kerül ki: különböző glikoproteinek (pl. Tamm–Horsfall-fehérje/uromodulin), poliszacharidok, illetve a vizelet elektrolitjei. A kondicionáló réteget képző egyes alkotóelemek szerepe és jelentősége vitatott, ellentmondásos eredmények léteznek (13). A vizelet mellett a vér alkotóelemei is szerepet játszhatnak a kondicionáló film létrejöttében (albumin, hemoglobin, fibrinogén, hiszton, gyulladáshoz kapcsolódó fehérjék: a1-antitripszin, citokeratin, immunoglobulin láncok – Ig-kappa, Ig-nehézlánc G1). Húgyvezetékstent felhelyezése esetén is lehetséges, hogy a stent felülete vizelet mellett vérrel is kapcsolatba kerül az urothelium sérülése révén (13, 19, 20, 21). A kondicionáló rétegben részt vevő vizelet és vér elemei mellett az idegen test felületének tulajdonságai is meghatározóak (pl. elektromos töltöttség, hidrofób karakter) (13, 15, 17). A kondicionáló film képződése azonnal megindul amint az idegen test kapcsolatba kerül a vizelettel és a vérrel (13), baktériumok jelenléte nélkül is. Ezen lépcsőfok kiemelkedően fontos a biofilm keletkezésében, hiszen a baktériumok enélkül nem, illetve nem kellőképpen tudnak hozzákötődni közvetlenül az idegen test felületéhez (13, 15, 16). A kondicionáló film további jelentőségét az adja, hogy mivel szinte teljesen beborítja az idegen test felszínét, ezáltal megváltoztatja, elfedi annak eredeti felületi tulajdonságait. Ez a legfontosabb oka a különböző speciális bevonatú idegen testek alacsony hosszú távú klinikai hatékonyságának. A kondicionáló réteg elengedhetetlen a további biofilm-formálódáshoz, megteremti annak második lépcsőfokát, amely során a baktériumok lehorgonyoznak az idegen test felületéhez. A baktériumok kötődése a felülethez kezdetben visszafordítható folyamat, köszönhetően többek között elektrosztatikus erőknek, majd irreverzibilis kötés alakul ki a baktérium által termelt poliszacharidok révén, amelyek lehorgonyozzák őket a stent felszínéhez. Az utolsó, harmadik lépcsőfok a biofilm létrejöttében a baktériumok elszaporodása, amely strukturált hálózatot képez. Ezen folyamatok eredményeképpen alakul ki az a mikrokörnyezet (mikrokolónia), ahol az elszaporodó baktériumok és az általuk termelt molekulák változatos hálózatot képeznek, amelyet biofilmnek nevezünk. A mikrokolóniák adják a biofilm alapvető szerkezeti egységeit. A mikrokolóniát 10-15%-ban baktériumok alkotják, míg 85-90%-ban poliszacharidok építik fel, amely arány az adott baktérium függvénye (13, 15, 16, 17).
A biofilmbe ágyazott baktériumok eltérő tulajdonsággal bírnak azon baktériumoktól, amelyek szabadon sodródnak (planktonikus baktériumok). Különböző molekulákat termelnek, amelyekkel közvetlen környezetüket befolyásolják, illetve más baktériumok génexpresszióját módosítva távoli, illetve nem a biofilmbe ágyazott baktériumokra is kihatnak.
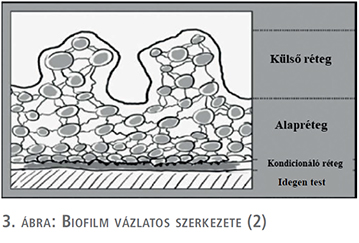
A biofilm jelenleg elfogadottnak tekinthető függőleges irányú rétegződése (3. ábra): közvetlenül az idegen test felületén helyezkedik a kondicionáló réteg, amelyet a lehorgonyzott baktériumokat tartalmazó alapréteg követi. Külső rétegben helyezkednek el azon baktériumok, amelyek elszakadva a biofilmtől szabadon sodródnak (2, 15, 16, 17).
A biofilm ellenállóképessége az antibiotikummal szemben
Annak érdekében, hogy jobban megértsük a biofilmmel szembeni antibakteriális küzdelem kihívásait, rá kell világítanunk a biofilm antibiotikummal szembeni fogékonyságára. Kézenfekvő megoldásnak kínálkozik az antibiotikum célzott alkalmazása, amelyet vizelettenyésztés alapján választunk meg. Az ellentmondás, illetve az antibiotikumkúra kudarca arra vezethető vissza, hogy a vizelettenyésztéssel a biofilmből kivált, szabadon sodródó baktériumokat lehetséges kimutatni. Mint tudjuk, ezen baktériumok eltérő tulajdonságokkal bírhatnak a biofilmbe lehorgonyzott társaikkal szemben. Kehinde és munkatársa vizsgálatára alapozva a vizelettenyésztés sok esetben negatív, ugyanakkor szövődményt okozó biofilmréteg helyezkedik el a húgyvezetékstent felületén (vizelettenyésztés szenzitivitása 40%-nak bizonyult) (22).
A vizelettenyésztés nem képes minden esetben a bakteriális kolonizációt, biofilmet képző baktériumot, és azok sokszínűségét kimutatni. Ezzel ellentétes megállapításra jutottak más kutatócsoportok a vizelettenyésztés szenzitivitását illetően: 93% (Al-Ghazo és munkatársa) (23) és 91% (Yeniyol és munkatársa) (24). Elfogadott álláspont, hogy az antibiotikumok nem tudják megakadályozni a biofilm képződését, legfeljebb lassítani tudja a folyamatot. A háttérben álló okokat az alábbiak szerint lehet összefoglalni (2, 15, 16, 17):
- „Extrinsic” ellenállóképesség: a biofilmet alkotó extracelluláris matrix megakadályozza az antibiotikumok bejutását, ezáltal védve a beágyazott baktériumot.
- „Intrinsic” ellenállóképesség: a biofilmbe horgonyzott baktériumok eltérő tulajdonsággal bírnak a szabadon keringő baktériumokhoz képest, amelyet génexpressziójuk módosításával érnek el. Ez az antibiotikumok célpontjainak megváltozását, így hatékonyságuk csökkenését eredményezi.
- A biofilmbe ágyazott baktériumok életciklusa, metabolikus folyamataik lassúbbak, ezáltal kevesebb támadáspontot kínálnak az antibiotikumoknak.
- Baktériumok közötti kommunikációs útvonalakon (pl. plazmid) keresztül a szabadon keringő és beágyazott baktériumok egymással akár antibiotikumrezisztenciát osztanak meg.
A fentebb felsorolt okok adhatnak magyarázatot azon figyelemre méltó adatra, miszerint a biofilmbe ágyazott baktériumok akár 1000-1500-szor magasabb antibiotikumkoncentrációt is képesek túlélni szemben a szabadon keringő baktériumokkal. Eddigi vizsgálatokra alapozva az antibiotikumok a szabadon keringő vagy nyálkahártya-felületen megtapadt baktériumok ellen hatékonyan képesek felvenni a küzdelmet, de idegen test felületén biofilmbe ágyazott baktériumokkal szemben hatástalanok (2, 15, 16, 17). Ezen okból adódóan antibiotikumok helyett más stratégiát kell választanunk, ha eredményesen szeretnénk a biofilmkézpződéssel szemben fellépni.
Biofilm elleni stratégia
Ezen stratégiák más megközelítéssel igyekeznek – a stent felületén kialakuló – a biofilm okozta szövődményeket csökkenteni, mint az antibiotikumok.
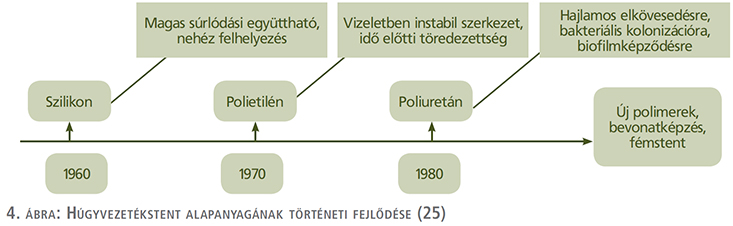
Történetileg elsőként a szilikon szolgált a húgyvezetékstent alapanyagául (4. ábra). Sok tekintetben a szilikon, mint első generációs stentösszetevő számít az aranyközépútnak. Felületének homogenitása révén bakteriális kolonizációnak és kőképződésnek kevésbé kitett összehasonlítva egyéb polimer anyaggal, illetve biokompatibilitása az urotheliummal szintén átlagon felüli, azonban magas súrlódási tényezője nem tette hosszútávon sikeressé húgyvezetékstent alapanyagaként (12, 25). A szilikont a polietilén váltotta a sorban, amely viszont tartósság tekintetében nem váltotta be a hozzá fűzött reményeket.
A szilikon és polietilén után a poliuretán mutatkozott be, mint a húgyvezetékstent alapanyaga és napjainkig is a legelterjedtebben alkalmazott összetevő (25).
Előnyei mellett – akárcsak más anyag esetén is – a poliuretán is rendelkezik néhány kedvezőtlen tulajdonsággal. A szilikonhoz képest nagyobb eséllyel nyújt kedvező felületet biofilmképződésre, ezáltal a stent elkövesedését okozva.
Minden bizonnyal utópikus elképzelés lenne azt gondolni, hogy létezik egy olyan anyag, amely minden tulajdonságával kielégíti a stentekkel kapcsolatos összes elvárásunkat (12, 17).
Tekintettel erre, alapvetően kettő megoldás kínálkozik, hogy a stent alapanyagaként legelterjedtebben felhasznált poliuretán tulajdonságain javítsunk.
Az egyik lehetséges megközelítés a poliuretán kémiai összetételének megváltoztatása különböző adalékanyag hozzáadásával. A másik megoldás a poliuretán stent felületén bevonat képzése. Az alábbiakban a bevonatképzést részletezzük.
Bevonatképzés
Ezen módszer a poliuretán kémiai összetételének megőrzése, viszont felületének különböző anyaggal való bevonása. Ezen módszert két csoportra oszthatjuk fel hatásmechanizmusok alapján: antimikrobiális anyagot bocsát ki a bevonat vagy önmagában antimikrobiális tulajdonsággal bír (12, 25). A bevonatképzés mind a múltban, mind a jelenben széles körben vizsgált terület. Számos tanulmány foglalkozott in vitro és in vivo kísérletek formájában a különböző bevonatot képző anyagokkal, úgymint (a teljesség igénye nélkül): heparin, hialuronsav, polivinilpirrolidon, ezüstion, nitrogén-oxid, kvaterner alumíniumsó, hidrogél, triclosan, nanoméretű gyémántszerkezetű szén, antibiotikumkibocsátó bevonat. A bíztató in vitro és in vivo eredmények ellenére ezen bevonattal rendelkező stentek nem terjedtek el a klinikai gyakorlatban széles körben, habár néhányuk elérhető a kereskedelmi forgalomban (12, 25, 26). A különböző antimikrobiális anyagot (pl. antibiotikum) kibocsátó stentbevonatok egy adott időintervallumon belül rendelkeznek előnnyel, viszont az adott időszakon kívül elveszítik antimikrobiális képességüket (az antibiotikumrezisztenciáról nem is szólva) (26). Ennek alapján hatékonyabb megoldásnak ígérkezik azon módszer, amikor a stentet bevonó anyag önmagában rendelkezik antimikrobiális aktivitással. Mint azt korábban említettük, a különböző bevonatok alacsony hosszú távú hatékonyságáért a kondicionáló réteg a felelős, amely elfedi a bevonatok felületmódosító tulajdonságait, továbbá a baktériumoknak az idegen test felszínéhez való hatékony kötődésében is elengedhetetlen.
A biofilm és szövődményei napjainkban is gondot okoznak, amely mozgatóerőként hat újabb vizsgálatok irányába. Számos – korábban már említett – in vitro és in vivo vizsgált bevonatképző anyag mellett akadnak újfent törekvések egy új, biofilmképződést mérséklő anyag fejlesztése érdekében.
Pandiyarajan és munkatársa, illetve Baghai és munkatársa bebizonyították, hogy bizonyos polimer anyagok (poli-N-alkil-akrilamid) képesek számottevő mértékben taszítani a humán fehérjék megtapadását a felületén. A szerzők szintén kimutatták, hogy ezen anyag nem csupán humán fehérjék, de humán sejtek felszínhez való kötődését is képes jelentős mértékben megakadályozni (27, 28). Ezen polimer anyagok közül a PDMAA (poli-N,N-dimetil-akrilamid) bizonyult a legígéretesebbnek. PDMAA vizes környezetben nagyfokú duzzadási képességgel bír, ezáltal nem mutat erős kölcsönhatást hidrofób kötések révén a fehérjékkel. A fehérjék, amelyek ezen a polimer anyagon igyekeznek megtapadni, taszító hatással szembesülnek molekulaméretük vagy termodinamikai hatás által (28). Pandiyarajan és munkatársa, illetve Baghai és munkatársa megvizsgálták a PDMAA taszító hatását különböző vérben megtalálható fehérjékkel (fibrinogén, fibronectin, von Willebrand-faktor) és a vér alakos elemeivel (humán és egér fibroblast, humán endothelsejt és vérlemezke) szemben. Az eredményeik előremutatóak, a PDMAA taszító hatását sikerült igazolniuk minden a vizsgálatban tesztelt fehérje és sejt ellen (27, 28). PDMAA ellenállóképességének vizsgálta során a leggyakoribb uropatogén baktériumokkal szemben történtek in vitro vizsgálatok, annak érdekében, hogy PDMAA biofilmképződés csökkentő hatása górcső alá kerüljön (29). Az eredmények megmutatták, hogy E. coli baktériumok szignifikáns mértékben kevesebb számban tudnak a PDMAA-val beborított felülethez kötődni. K. pneumonia és E. faecalis esetén nem mutatkozott szignifikáns különbség a PDMAA-val bevont felületeken, bár tendenciáját tekintve kevesebb baktérium kötődött a felületéhez. Ezen eredmények nincsenek teljes mértékben összhangban a korábbi munkacsoportok eredményeivel (27, 28). Magyarázatként szolgálhat, hogy az uropatogén baktériumok teljességgel eltérő mikroorganizmusok szemben a humán fiziológiás sejtekkel, amelyeket korábban vizsgáltak. A baktériumok számos virulenciafaktorral rendelkeznek, amelyek számottevően befolyásolják a viselkedésüket és kötődési képességüket idegen testek felületén (30–35).
Következtetés
A húgyvezetékstent felületén végbemenő biofilmképződés részletes folyamatának megismerése szükséges annak érdekében, hogy az általa okozott szövődmények megelőzésére hatékony támadáspontot találjunk. Keletkezésének az in vivo körülményekhez legjobban illeszkedő in vitro modell kidolgozása és egységes alkalmazásával juthatnánk mindehhez közelebb. Nem szabad megfeledkeznünk azonban az in vivo vizsgálatok jelentőségéről sem. Számos kísérlet és kezelési lehetőség áll jelenleg is rendelkezésünkre a stent felszínén lévő biofilmképződés csökkentésére, megakadályozására. Ezek közül sok kereskedelmi forgalomban is elérhető, azonban ezidáig egyik sem volt képes klinikai vizsgálatokban egyetemes sikert elérni. Ennek oka abban rejlik, hogy az adott körülmények (pl. vizelet összetétele, különböző baktériumok és azok különböző virulenciafaktorai) igen szerteágazóak. A biofilm kialakulásának megakadályozása érdekében a mikrobiológiai tényezők mellett a stent és környezetének (vizelet, felső húgyutak hámborítása, stentelt húgyvezetékben lévő áramlási viszonyok) kapcsolatát is figyelembe kell venni. Ezen sokszínűség nem teszi lehetővé, hogy csupán egy anyag, illetve egy kezelési stratégia önmagában sikeres legyen. Mint az orvostudomány sok területén, a biofilm elleni védekezésben is az egyénre szabott, az adott páciensnél fennálló kóroki tényezők figyelembevételével megválasztott stent adhatna legjobb eredményt.
References
1. Zimskind PD, Fetter TR, Wilkerson JL. Clinical use of long-term indwelling silicone rubber ureteral splints inserted cystoscopically. J Urol 1967 May; 97(5): 840–4.
2. Tenke P, Riedl CR, Jones GL, et al. Bacterial biofilm formation on urologic devices and heparin coating as preventive strategy. Int J Antimicrob Agents 2004 Mar; 23(Suppl 1): S67–74.
doi: https://doi.org/10.1016/j.ijantimicag.2003.12.007
3. Joshi HB, Stainthorpe A, Keeley FX Jr, et al. Indwelling ureteral stents: evaluation of quality of life to aid outcome analysis. J Endourol 2001 Mar; 15(2): 151–4 doi: https://doi.org/10.1089/089277901750134421
4. Leibovici D, Cooper A, Lindner A, et al. Ureteral stents: morbidity and impact on quality of life. Isr Med Assoc J 2005 Aug; 7(8): 491–4.
5. Lamb AD, Vowler SL, Johnston R, et al. Meta-analysis showing the beneficial effect of a-blockers on ureteric stent discomfort. BJU Int 2011 Dec; 108(11): 1894–902. doi: https://doi.org/10.1111/j.1464-410X.2011.10170.x
6. Park SC, Jung SW, Lee JW, et al. The effects of tolterodine extended release and alfuzosin for the treatment of double-j stent-related symptoms. J Endourol 2009 Nov; 23(11): 1913–7.
doi: https://doi.org/10.1089/end.2009.0173
7. Betschart P, Zumstein V, Piller A, et al. Prevention and treatment of symptoms associated with indwelling ureteral stents: A systematic review. Int J Urol 2017 Apr; 24(4): 250–259. doi: https://doi.org/10.1111/iju.13311
8. Beddingfield R, Pedro RN, Hinck B, et al. Alfuzosin to relieve ureteral stent discomfort: a prospective, randomized, placebo controlled study. J Urol 2009 Jan; 181(1): 170–6. doi: https://doi.org/10.1016/j.juro.2008.09.026
9. Staubli SE, Mordasini L, Engeler DS, et al. Economic Aspects of Morbidity Caused by Ureteral Stents. Urol Int 2016; 97(1): 91–7.
doi: https://doi.org/10.1159/000443379
10. Riedl CR, Plas E, Hübner WA, et al. Bacterial colonization of ureteral stents. Eur Urol 1999; 36(1): 53–9. doi: https://doi.org/10.1159/000019927
11. Farsi HM, Mosli HA, Al-Zemaity MF, et al. Bacteriuria and colonization of double-pigtail ureteral stents: long-term experience with 237 patients. J Endourol 1995 Dec; 9(6): 469–72. doi: https://doi.org/10.1089/end.1995.9.469
12. Liatsikos E, Kallidonis P, Stolzenburg JU, et al. Ureteral stents: past, present and future. Expert Rev Med Devices 2009 May; 6(3): 313–24.
doi: https://doi.org/10.1586/erd.09.5
13. Zumstein V, Betschart P, Albrich WC, et al. Biofilm formation on ureteral stents – Incidence, clinical impact, and prevention. Swiss Med Wkly 2017 Feb 6; 147: w14408. doi: https://doi.org/10.4414/smw.2017.14408
14. Costerton JW, Cheng KJ, Geesey GG, et al. Bacterial biofilms in nature and disease. Annu Rev Microbiol 1987; 41: 435–64.
doi: https://doi.org/10.1146/annurev.mi.41.100187.002251
15. Choong S, Whitfield H. Biofilms and their role in infections in urology. BJU Int 2000 Nov; 86(8): 935–41.
doi: https://doi.org/10.1046/j.1464-410x.2000.00949.x
16. Tenke P, Köves B, Nagy K, et al. Update on biofilm infections in the urinary tract. World J Urol 2012 Feb; 30(1): 51–7.
doi: https://doi.org/10.1007/s00345-011-0689-9
17. Tenke P, Kovacs B, Jäckel M, et al. The role of biofilm infection in urology. World J Urol 2006 Feb; 24(1): 13–20.
doi: https://doi.org/10.1007/s00345-005-0050-2
18. Rosman BM, Barbosa JA, Passerotti CP, et al. Evaluation of a novel gel-based ureteral stent with biofilm-resistant characteristics. Int Urol Nephrol 2014 Jun; 46(6): 1053–8. doi: https://doi.org/10.1007/s11255-013-0636-3
19. Elwood CN, Lo J, Chou E, et al. Understanding urinary conditioning film components on ureteral stents: profiling protein components and evaluating their role in bacterial colonization. Expert Rev Med Devices 2009 May; 6(3): 313–24. doi: https://doi.org/10.1080/08927014.2013.829049
20. Canales BK, Higgins L, Markowski T, et al. Presence of five conditioning film proteins are highly associated with early stent encrustation. J Endourol 2009 Sep; 23(9): 1437–42.
doi: https://doi.org/10.1089/end.2009.0389
21. Santin M, Motta A, Denyer SP, et al. Effect of the urine conditioning film on ureteral stent encrustation and characterization of its protein composition. Biomaterials 1999 Jul; 20(13): 1245–51.
doi: https://doi.org/10.1016/S0142-9612(99)00026-5
22. Kehinde EO, Rotimi VO, Al-Hunayan A, et al. Bacteriology of urinary tract infection associated with indwelling J ureteral stents. J Endourol 2004 Nov; 18(9): 891–6. doi: https://doi.org/10.1089/end.2004.18.891
23. Al-Ghazo MA, Ghalayini IF, Matani YS, et al. The risk of bacteriuria and ureteric stent colonization in immune-compromised patients with double J stent insertion. Int Urol Nephrol 2010 Jun; 42(2): 343–7.
doi: https://doi.org/10.1007/s11255-009-9607-0
24. Yeniyol CO, Tuna A, Yener H, et al. Bacterial colonization of double J stents and bacteriuria frequency. Int Urol Nephrol 2002; 34(2): 199–202. doi: https://doi.org/10.1023/A: 1023285422278
25. Venkatesan N, Shroff S, Jayachandran K, et al. Polymers as ureteral stents. J Endourol 2010 Feb; 24(2): 191–8.
doi: https://doi.org/10.1089/end.2009.0516
26. Gultekinoglu M, Tunc Sarisozen Y, Erdogdu C, et al. Designing of dynamic polyethyleneimine (PEI) brushes on polyurethane (PU) ureteral stents to prevent infections. Acta Biomater 2015 Jul; 21: 44–54.
doi: https://doi.org/10.1016/j.actbio.2015.03.037
27. Pandiyarajan CK, Prucker O, Zieger B, et al. Influence of the molecular structure of surface-attached poly(N-alkyl acrylamide) coatings on the interaction of surfaces with proteins, cells and blood platelets. Macromol Biosci 2013 Jul; 13(7): 873–84. doi: https://doi.org/10.1002/mabi.201200445
28. Baghai M, Tamura N, Beyersdorf F, et al. Platelet repellent properties of hydrogel coatings on polyurethane-coated glass surfaces. ASAIO J 2014 Sep-Oct; 60(5): 587–93.
doi: https://doi.org/10.1097/MAT.0000000000000118
29. Szell T, Dressler FF, Goelz H, et al. In Vitro Effects of a Novel Coating Agent on Bacterial Biofilm Development on Ureteral Stents. J Endourol 2019 Mar; 33(3): 225–231. doi: https://doi.org/10.1089/end.2018.0616
30. Ong CL, Ulett GC, Mabbett AN, et al. Identification of type 3 fimbriae in uropathogenic Escherichia coli reveals a role in biofilm formation. J Bacteriol 2008 Feb; 190(3): 1054–63.
doi: https://doi.org/10.1128/JB.01523-07
31. Kostakioti M, Hadjifrangiskou M, Hultgren SJ. Bacterial biofilms: development, dispersal, and therapeutic strategies in the dawn of the postantibiotic era. Cold Spring Harb Perspect Med 2013 Apr 1; 3(4): a010306. doi: https://doi.org/10.1101/cshperspect.a010306
32. Clegg S, Murphy CN. Epidemiology and Virulence of Klebsiella pneumoniae. Microbiol Spectr 2016 Feb; 4(1).
doi: https://doi.org/10.1128/microbiolspec.UTI-0005-2012
33. Stahlhut SG, Struve C, Krogfelt KA, et al. Biofilm formation of Klebsiella pneumoniae on urethral catheters requires either type 1 or type 3 fimbriae. FEMS Immunol Med Microbiol 2012 Jul; 65(2): 350–9.
doi: https://doi.org/10.1111/j.1574-695X.2012.00965.x
34. Guiton PS, Hung CS, Hancock LE, et al. Enterococcal biofilm formation and virulence in an optimized murine model of foreign body-associated urinary tract infections. Infect Immun 2010 Oct; 78(10): 4166–75. doi: https://doi.org/10.1128/IAI.00711-10
35. Mohamed JA, Huang DB. Biofilm formation by enterococci. J Med Microbiol 2007 Dec; 56(Pt 12): 1581–8.
doi: https://doi.org/10.1099/jmm.0.47331-0