Darolutamide – a new drug in the treatment of non-metastatic, castration-resistant prostate cancer
DOI: 10.22591/magyurol.2021.2.pikob.53
Authors:
Pikó Béla dr.1, Bassam Ali dr.1, Mészáros Tibor dr.2, Laczó Ibolya dr.1,Veréb Blanka dr.1, Csikósné Mácsok Erzsébet1
1Békés Megyei Központi Kórház Pándy Kálmán Tagkórház, Megyei Onkológiai Központ, Gyula (centrumvezető: Pikó Béla dr.)
2Békés Megyei Központi Kórház Pándy Kálmán Tagkórház, Urológiai Osztály, Gyula (osztályvezető: Mészáros Tibor dr.)
Summary
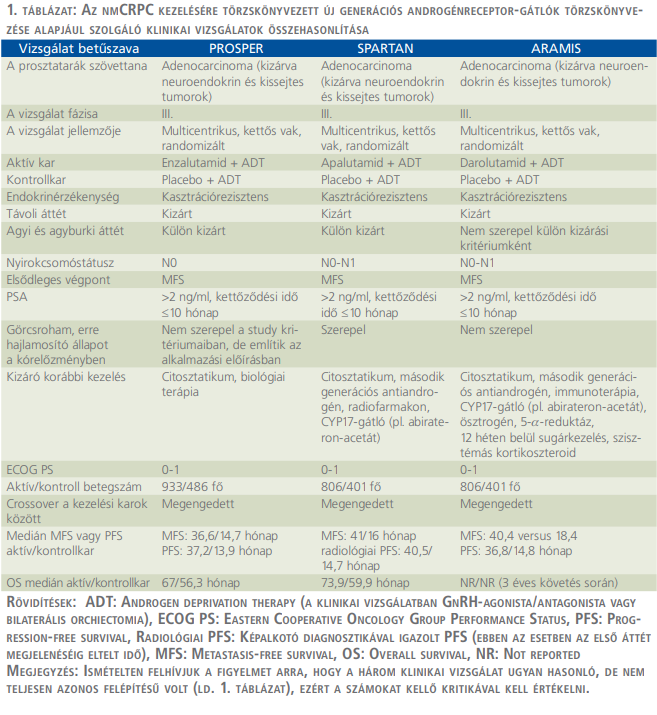
Although patients with non-metastatic castration-resistant prostate cancer are usually asymptomatic, but the disease eventually progresses to metastatic in 60% of cases within 5 years. The management of the disease are provided by the new – or second – generation androgen receptor inhibitors (enzalutamide, apalutamide and, most recently, darolutamide), the efficacy of which has been demonstrated in similarly designed phase III. clinical trials (PROSPER, SPARTAN, ARAMIS).
Although the task of the oncoteam is not necessarily to suggest the statistically expected “most effective” drug based on the patient’s general condition, concomitant diseases, preferences, but to be the „safest” and „most acceptable” for the patient. Consideration may be that the relative hazard for mortality reduction for darolutamide was more favourable in the study (–31%) than in the studies with apalutamide (–22%) and enzalutamide (–27%).
Darolutamide has a flexible, polar molecular structure that binds with high affinity to wild-type and mutant androgen receptors and does not increase serum testosterone levels in monotherapy. Due to its structure, it crosses little through the blood-brain barrier, to a lesser extent than the other next-generation androgen receptor inhibitors. Its side effect profile is favourable.
However, direct comparative data of next-generation androgen receptor inhibitors are not available, Darolutamid can be considered an effective and safe agent based on the results of clinical trials.
LAPSZÁM: MAGYAR UROLÓGIA | 2020 | 33. ÉVFOLYAM, 2. SZÁM
Összefoglalás
A nem metasztatikus, kasztrációrezisztens prosztatarák – bár a betegek általában tünetmentesek – 5 éven belül az esetek 60%-ában áttétessé válik. A kezelés lehetőségét az új – vagy második – generációs androgénreceptor-gátlók (enzalutamid, apalutamid és legújabb szerként a darolutamid) adják, amelyek hatásosságát hasonló felépítésű klinikai vizsgálatokban (PROSPER, SPARTAN, ARAMIS) igazolták.
Bár az onkoteam feladata a beteg általános állapota, kísérő betegségei, preferenciái alapján nem feltétlenül a statisztikailag „várhatóan leghatásosabb”, hanem az adott páciens szempontjából „legbiztonságosabb” és „legelfogadhatóbb” szer javaslata. Mérlegelési szempont lehet, hogy a darolutamid esetében a mortalitás kockázatának csökkenésére vonatkozó relatív hazárd a vizsgálatban kedvezőbb értéket mutatott (–31% volt) az apalutamiddal (–22%) és az enzalutamiddal (–27%) végzett vizsgálatok eredményeinél. A darolutamid flexibilis szerkezetű, poláris molekula, amely a vad típusú és mutáns androgénreceptorokhoz nagy affinitással kötődik, és monoterápiában sem emeli a szérum tesztoszteronszintjét. Struktúrája következtében a vér–agy gáton kevéssé – a többi új generációs androgénreceptor-gátló közül a legkisebb mértékben – halad át. Mellékhatásprofilja kedvező. Bár a többi készítménnyel nem végeztek közvetlen összehasonlítást, a Darolutamid a klinikai vizsgálatok eredményei alapján hatásos és biztonságos szernek mondható.
Bevezetés
A prosztatarákot – jellemzően különféle differenciáltságú adenokarcinómát – valamikor kizárólag hormonterápiát igénylő, csak arra reagáló, de azzal sikeresen is kezelhető daganatként tartottuk számon, amely az időskor betegsége. Időközben szembesülnünk kellett azzal, hogy ez a kórkép a hatodik helyen áll a teljes, és az ötödik (hazánkban a negyedik) helyen a férfi daganatos halálozásban, mind fiatalabbak a betegek, és az első öt évben akár 10-30%-ban (korábban endokrin-rezisztenciaként ismert) kasztrációrezisztencia. Mi több, az egyre bővülő terápiás lehetőségek mellett egyre nagyobb hangsúlyt kap a túlkezelés elkerülésére pl. a szervre lokalizált daganatok esetében (active surveillance) és az „éber várakozás” (watchful waiting) filozófiája is (1–6).
A prosztatarák kezelése számos tényezőtől függ: pl. a folyamat kiterjedésétől (korai, lokoregionálisan előrehaladott, oligo- vagy multimetasztatikus), differenciáltságától, a kiindulási PSA-szinttől, az endokrin kezelés iránti érzékenységtől, az okozott panaszoktól, a betegek életkorától, általános állapotától, kísérőbetegségeitől, az adott terápiába való beleegyezésétől vagy annak hiányától, és újabban a daganat genetikai jellegzetességeitől, valamely eljárással szembeni érzékenységet előjelző tulajdonságaitól is. A számos lehetőség közötti felelősségteljes választás nem képzelhető el a szakmailag illetékes szakorvosok közös, konszenzusos javaslata (onkoteam működése) nélkül (2, 6). Dolgozatunknak nem célja a teljes terápiás paletta és az egyes kezelések indikációs köreinek bemutatására, mivel ezzel kapcsolatban az európai és észak-amerikai irányelvek mellett részletes és igényes hazai tanulmányok is megjelentek (1, 2, 5, 8, 9).
A nem metasztatikus, kasztrációrezisztens prosztatarák (nmCRPC – non-metastatic castration resistant prostate cancer)
A nem metasztatikus betegség kimondásához a „hagyományos” képalkotó vizsgálatok (mellkasi, hasi, medencei CT és 99mTc-vel végzett csontszcintigráfia) lelete szükséges (annak tudtában is, hogy a speciális vizsgálatok – pl. 11C-kolin PET/CT vagy PSMA [prostate-specific membrane antigen] PET-CT érzékenysége és fajlagossága magasabb). A kasztrációrezisztencia feltétele a terápiás tesztoszteronszint (<1,7 nmol/l), emelkedő, valamint az elért nadírnál 25%-kal magasabb, és legalább 2 µg/l PSA-érték (1, 2, 4, 8, 9). Annak ellenére, hogy a kórkép látszólag „nyugalomban van”, és a betegek jellemzően tünetmentesek, a statisztikai adatok szerint 5 éven belül a betegek 60%-ában áttétek alakulnak ki, leggyakrabban az első három évben (3, 5, 6). Ebben a stádiumban a közelmúltig a betegek ellátásában az eddig alkalmazott hormonkezelést (ADT „androgen deprivation therapy”) folytattuk „annak ellenére, hogy ezek mellett következett be a PSA emelkedése, amely az áttétes folyamat megjelenését jósolta”. Megpróbáltunk a hormonok közül másik készítményt alkalmazni, vagy megvitattuk annak lehetőségét, hogy a prosztata (és régióinak) sugárkezelése rendezheti-e az állapotot, esetleg felvetettük a docetaxel indikáción túli adásának lehetőségét az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet (OGYÉI) egyedi engedélye alapján. Ha pesszimista megfogalmazással kívánunk élni, azt is mondhatjuk: a PSA értékének rendszeres ellenőrzése mellett – annak tudtában, hogy a kettőződési idő prognosztikus jelentőségű – vártunk az áttétek megjelenésére, amikor már az újabb fejlesztésű és hatásos, a metasztatikus betegség kezelésére szolgáló gyógyszereket alkalmazhatjuk (1, 5, 10, 11).
Az nmCRPC kezelésére törzskönyvezett gyógyszerek
A terápiás lehetőséget az új – vagy második – generációs androgénreceptor-gátlók (second-generation antiandrogens) adták, amelyek eltérő kémiai szerkezetűek, de valamennyien a férfi nemi hormonok bioszintézisére hatnak; kompetitív módon akadályozzák az androgénreceptorok (AR) által közvetített jelátvitelt, valamint a sejtmagban történő transzkripciót. Ennek következtében a daganatsejtek proliferációjának gátlását eredményezik, és potens tumorellenes hatást fejtenek ki (1–3, 6, 12).
2018-ban, a PROSPER betűszóval jelölt, III. fázisú, multicentrikus, kettős vak, randomizált klinikai vizsgálatban az enzalutamid (Xtandi®) és az ADT (androgen deprivation therapy) kombinációját hasonlították össze ADT + placebo (PLB) kezeléssel. Ugyanabban az évben, hasonló felépítésű studyban (SPARTAN) az ADT + apalutamid (Erleada®) effektusát mérték össze az ADT + PLB monoterápiáéval. 2019-ben került sor a darolutamid (Nubeqa®) – a korábbiakkal megegyezően felépített – vizsgálatára (ARAMIS). Bár a három vizsgálat eredményeit az 1. táblázatban egymás mellett bemutatjuk, felhívjuk a figyelmet arra, hogy a feltételek bár hasonlóak, de nem azonosak voltak, s közvetlen összehasonlítás a hatóanyagokkal nem történt, és ezért az egyes értékek egybevetése csak komoly fenntartással lehetséges. Ezért úgy tűnik, hogy a három készítmény közötti választást a táblázatban szereplő időtartamok (metasztázis kialakulásáig, progresszióig tartó vagy teljes túlélés) nem döntik el „automatikusan” (amit minden beteg, azaz külön individuum esetében amúgy is elkerülni szükséges) (1, 2, 4, 6, 8, 9, 12, 13).
Az új generációs AR-gátlókkal végzett kezelés megkezdésének célja, hogy az áttétek kialakulását késleltessük, és így a pácienst a lehető leghosszabb ideig tartsuk az nmCRPC stádiumában, és ezzel az össztúlélés időtartamát (M0 és M1 betegség együtt) megnyújtsuk. Fontos ugyanakkor, hogy a (jellegzetesen tünetmentes) betegek életminőségét megőrizzük, és olyan terápiát válaszunk, ami mindennapi tevékenységüket a lehető legkevésbé befolyásolja (1, 2, 4, 5, 12, 15, 16).
A betegek általános állapotát, kísérőbetegségeit, preferenciáit ismerő szakorvos feladata nem feltétlenül a statisztikailag várhatóan „leghatásosabb”, hanem az adott páciens szempontjából „legbiztonságosabb” és „legelfogadhatóbb” szer javaslata, amelyet az onkoteam figyelembe vesz (1, 3, 4, 6, 8, 12, 15–18). Ennek az elvnek a fenntartása mellett mérlegelési szempont lehet, hogy a mortalitás kockázatcsökkenésére vonatkozó relatív hazárd a darolutamid esetében −31% volt mely kedvezőbb a más gyógyszerekkel végzett vizsgálatok eredmányeinél (apalutamid: −22%, enzalutamid: −27%) (14, 15).
A 2. táblázatban mutatjuk be az új generációs androgénreceptor-gátlók főbb mellékhatásait az alkalmazási előírások alapján.
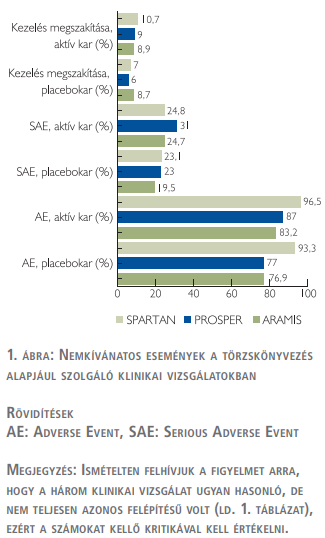
A három hatóanyag törzskönyvezése alapjául szolgáló nemkívánatos eseményeket (adverse events) az 1. ábra tartalmazza (3, 6, 13–15, 19, 20).
A darolutamid
A darolutamid (DARO) flexibilis szerkezetű, poláris molekula, amely mind a vad típusú, mind a mutáns androgénreceptorokhoz nagy affinitással kötődik, ez (legalábbis preklinikai vizsgálatokban) meghaladja az enzalutamid és az apalutamid kompetitív kapcsolódását, és monoterápiában sem emeli a szérum tesztoszteronszintjét. Struktúrája következtében a vér–agy gáton kevéssé – a többi új generációs AR-gátlók közül a legkisebb mértékben – halad át. Ez a görcskészség csökkentését és a kognitív funkciók jobb megőrzését eredményezi (viszont megkérdőjelezheti a – viszonylag ritkán, de kialakuló – agyi és agyburki áttétekben történő adásának hatásosságát, bár hangsúlyozni kell, hogy ezzel kapcsolatban – a klinikai vizsgálatok alapján, valamint megfelelő „post-study” [real-world] tapasztalatok hiányában – sem pro, sem kontra adatokkal nem rendelkezünk). Az ARAMIS klinikai vizsgálat post hoc analízise szerint a DARO nem befolyásolta klinikailag releváns mértékben a statinok, béta-blokkolók, trombózisellenes szerek és antibiotikumok farmakokinetikáját (1, 3, 4, 15, 18).
A mellékhatások is kedvezően alakultak a klinikai vizsgálatban: nem tértek el jelentősen a kezelés aktív és a kontrollkarján; a gyengeség (fatigue) kivételével nem volt 5%-ot megközelítő különbség a két betegcsoportban (amit természetesen az átjárhatóság [crossing] is befolyásolt). Mivel a szert az FDA 2019. 07. 30-án, az EMA pedig 2020. 03. 27-én törzskönyvezte, nem állnak rendelkezésre a mindennapos klinikai gyakorlatban szerzett tapasztalatokról beszámoló közlemények (ahogy ezt korában jeleztük), így az ARAMIS klinikai vizsgálat adatait tudjuk elemezni.
A DARO nem befolyásolta a QT-intervallumot. Az iszkémiás szívbetegség és szívelégtelenség a nagyon gyakori és gyakori mellékhatások között szerepelt (DARO alkalmazása esetén az ISZB előfordulása 3,2%, PLB mellett 2,5%, a szívelégtelenségé 1,9% versus 0,9%), és bár ezek az értékek nem tűnnek végzetesen kockázatosnak, a kezelés megkezdése előtt és alatt a betegek kardiális állapotát ellenőrizni szükséges. A magas vérnyomás 7,8%-ban (grade 3-4: 3,5%) fordult elő az aktív kezelési karon, míg a kontrollcsoportban ezek az arányok 6,5% és 2,5% voltak. A hipertónia csoportmellékhatásról a PROSPER-vizsgálatban ennek mintegy duplájáról, a SPARTAN-vizsgálatban közel négyszereséről számoltak be (3, 6, 14, 20).

A fő mellékhatás a fáradékonyság volt (DARO: 13,2% [súlyos, azaz grade 3-4: 0,4%], PLB: 8,3% [grade 3-4: 0,9%], de ez az új generációs AR-gátlóknál ugyancsak csoportmellékhatásnak tekinthető, és a többi szer klinikai vizsgálatában észleltnél ritkábban fordult elő. A nem metasztatikus eredetű csonttörések gyakorisága a következőképpen alakult: DARO: 5,5% (súlyos 0,9%), PLB: 4,9% (súlyos: 0,7%). Ezek a számok felhívják a figyelmet arra, hogy (bármilyen) tartós hormonkezelés esetén szükséges a csontsűrűség ellenőrzése, szükség esetén „csontvédő” terápia beállítása. Elesés az aktív karon 5,2%-ban (súlyos következményekkel 0,9%-ban), a kontrollcsoportban 4,9%-ban (súlyos hatásokkal 0,7%-ban) fordult elő.

A csökkent neutrofilszám az alkalmazási előírás szerint egy betegnél tette szükségessé a kezelés befejezését, döntően átmeneti vagy reverzibilis volt, és nem járt együtt semmiféle, klinikai szempontból releváns jellel vagy tünettel. A májfunkciós értékek eltérése (emelkedett szérumbilirubin vagy SGOT) nem társult klinikai következményekkel, reverzibilisek voltak, a darolutamidkezelés felfüggesztése után rendeződtek, és egyetlen páciensnél sem volt szükséges a DARO-kezelés végleges befejezése. Bőrtünet (rash) kialakulhat (az apalutamid adásakor tapasztalhatóhoz hasonlóan, de annál ritkábban). Kezelése orális antihisztamin, lokális vagy szisztémás kortikoszteroid, a kezelés átmeneti felfüggesztése, esetleg a – tünet súlyosságától függően – a dózis módosítása (2–4, 6, 8, 12–14, 20).
Következtetés
A DARO az új generációs AR-gátlók közé tartozik, amit az EMA 2020-ban törzskönyvezett, így a mindennapos betegellátásban szerzett tapasztalatokról még nem beszélhetünk. Bár a többi készítménnyel nem végeztek közvetlen összehasonlítást, a klinikai vizsgálatok eredményei alapján hatásos és biztonságos szernek mondható. A betegek kiválasztása és követése során a kardiális állapot és a vérnyomás ellenőrzése mellett szükség lehet a gyengeség kezelésére, esetleg csontvédő terápia beállítására. A többi készítményhez képest kiemelendő a vér–agy gáton való kismértékű áthatolás ennek minden konkrét előnyével (görcsrohamok elenyésző kockázata) és potenciális hátrányával (agyi és agyburki áttétekre kifejtett kisebb hatás elvi lehetősége), jóllehet ezt a teóriát sem igazolni, sem kizárni nem lehetett.
A készítmények közötti választást minden esetben egyénileg kell eldönteni, figyelembe véve, hogy az nmCRPC jellegzetesen tünetmentes állapot, és az áttétek kialakulásának késleltetése mellett a beteg életminőségének megőrzése és mindennapi életvitelének lehető legkisebb korlátozása is fontos terápiás cél.
Hasznosnak tartanánk a szerrel kapcsolatosan betegtámogató program szervezését, amely a betegek biztonságát, az adott egészségügyi intézménnyel való kapcsolatuk egyszerűsítését, jobb együttműködést, a mindennapos gyakorlatban jelentkező mellékhatások pontos felmérését egyaránt segítené.
References
1. Maráz A, Géczi L, Bíró K, et al. Terápiás szekvenciák az előrehaladott/áttétes prosztatadaganatok gyógyszeres kezelésében. Magy Onkol 2020; 64: 263–272.
2. Schaeffer E, Srinivas S, Antonarakis ES, et al. Prostate cancer. Version 3.2020. – November 17 2020. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®).
https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf
3. Alpajaro SIR, Harris JAK, Evans CP. Non-metastatic castration resistant prostate cancer: a review of current and emerging medical therapies. Prostate Cancer Prostatic Dis. 2019; 22(1): 16–23.
https://doi.org/10.1038/s41391-018-0078-1
4. Scott, LJ. Darolutamide: A Review in Non-Metastatic Castration-Resistant Prostate Cancer. Targ Oncol 2020; 15: 791–799.
https://doi.org/10.1007/s11523-020-00779-x
5. Szűcs M, Szalontai M, Nyírády P. A prosztatarák diagnosztikája és kezelése napjainkban. Orvostovképz Szle 2020; 28(12): 37–45.
6. Géczi L. A nem áttétes kasztrációrezisztens (nmCRPC) prosztatarák új kezelési lehetőségei. Magy Urol 2020; 32(2): 58–60.
7. Bíró K, Géczi L. A mozgás szerepe a prosztatarák megelőzésében és kezelésében. Magy Onkol 2019; 63: 60–64.
8. Parker C, Castro E, Fizazi K, et al. Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2020; 31(9): 1119–1134. https://doi.org/10.1016/j.annonc.2020.06.011
9. Cornford P, van den Bergh RCN, Briers E, et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer. Part II-2020 Update: Treatment of Relapsing and Metastatic Prostate Cancer. Eur Urol. 2020. https://www.sciencedirect.com/science/article/abs/pii/S0302283820307739?via%3Dihub
10. Mai L, Li Y, Yang P, et al. Successful management of prostate cancer with bulky pelvic lymph node metastases after rapid development of castration-resistant prostate cancer: a case report with review of the literature. Transl Androl Urol 2020; 9(3): 1428–1436.
https://doi.org/10.21037/tau-20-725
11. Ito K, Kimura T, Onuma H, et al. Does docetaxel prolong survival of patients with non-metastatic castration-resistant prostate cancer? Prostate 2018; 78(7): 498–505. https://doi.org/10.1002/pros.23493
12. Rice MA, Malhotra SV, Stoyanova T. Second-Generation Antiandrogens: From Discovery to Standard of Care in Castration Resistant Prostate Cancer. Front Oncol 2019; 28, 9, 801. Published online 2019 Aug 28. https://doi.org/10.3389/fonc.2019.00801
13. Crawford ED, Stanton W, Mandair D. Darolutamide: An Evidenced-Based Review of Its Efficacy and Safety in the Treatment of Prostate Cancer. Cancer Manag Res 2020; 12: 5667–5676.
https://doi.org/10.2147/CMAR.S227583
14. Fizazi K, Shore N, Tammela TL, et al. Nonmetastatic, Castration-Resistant Prostate Cancer and Survival with Darolutamide. N Engl J Med 2020; 383: 1040–1049. https://doi.org/10.1056/NEJMoa2001342
15. Mori K, Mostafaei H, Pradere B, et al. Apalutamide, enzalutamide, and darolutamide for non‑metastatic castration‑resistant prostate cancer: a systematic review and network meta‑analysis. Int J Clin Oncol 2020; 25(11): 1892–1900. https://doi.org/10.1007/s10147-020-01777-9
16. Mateo J, Fizazi K, Gillessen S, et al. Managing Non-metastatic Castration-resistant Prostate Cancer. Eur Urol 2019; 75(2): 285–293.
https://doi.org/10.1016/j.eururo.2018.07.035
17. Hussain M, Fizazi K, Saad F, et al. Enzalutamide in Men with Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2018; 378: 2465–2474. https://doi.org/10.1056/NEJMoa1800536
18. Srinivas S, Mohamed AF, Appukkuttan S. et al. Physician preferences for non-metastatic castration-resistant prostate cancer treatment. BMC Urol 2020; 20: 73. https://doi.org/10.1186/s12894-020-00631-4
19. Ryan C, Wefel JS, Morgans AK. A review of prostate cancer treatment impact on the CNS and cognitive function. Prostate Cancer Prostatic Dis 2020; 23(2): 207–219. https://doi.org/10.1038/s41391-019-0195-5
20. Bastos DA, Antonarakis ES. Darolutamide For Castration-Resistant Prostate Cancer. Onco Targets Ther 2019; 12: 8769–8777.
https://doi.org/10.2147/OTT.S197244
Az irodalomjegyzékben szereplő közleményeken túl az egyes klinikai vizsgálatokról információt szerezhetünk az alábbi weboldalakon, valamint az egyes készítmények alkalmazási előírásában.
• Safety and Efficacy Study of Enzalutamide in Patients With Nonmetastatic Castration-Resistant Prostate Cancer (PROSPER).
https://clinicaltrials.gov/ct2/show/NCT02003924
• A Study of Apalutamide (ARN-509) in Men With Non-Metastatic Castration-Resistant Prostate Cancer (SPARTAN).
https://clinicaltrials.gov/ct2/show/NCT01946204
• Efficacy and Safety Study of Darolutamide (ODM-201) in Men With High-risk Nonmetastatic Castration-resistant Prostate Cancer (ARAMIS). https://clinicaltrials.gov/ct2/show/NCT02200614
• Alkalmazási előírás. Xtandi 40 mg lágy kapszula.
https://www.ema.europa.eu/en/documents/product-information/xtandi-epar-product-information_hu.pdf
• Alkalmazási előírás. Erleada 60 mg filmtabletta.
https://www.ema.europa.eu/en/documents/product-information/erleada-epar-product-information_hu.pdf
• Alkalmazási előírás. NUBEQA 300 mg filmtabletta.
https://www.ema.europa.eu/en/documents/product-information/nubeqa-epar-product-information_hu.pdf