Infection control and bacterial multidrug resistance issues in urology departments
DOI: 10.22591/magyurol.2022.1.peterfil.8
Authors:
Péterfi Lehel dr., Szántó Árpád dr., Villányi Kinga dr.
Pécsi Tudományegyetem KK, Urológiai Klinika, Pécs (igazgató: Szántó Árpád dr.)
Summary
Recently there have been changes and new information on urogenital infections, especially catheters/foreign bodies related types have occurred, that has practical implications and may help the work of urological departments and associates. Our summary based on the database Urological Clinic of the Pécs University and the infection control practice, taking into account the recommendations of the European Society of Urologists (EAU) and the American Society of Urologists (AUA). We also took part in the compilation of a methodological letter issued by the Hungarian Chief Medical Officer on the prevention of urinary tract infections related to bladder catheters.
In urology departments, urinary tract infections associated with foreign bodies and caused by multidrug-resistant strains are higher than in other departments. Public health, infection control, and hygienic aspects of the problem have been reported, requiring the development of novelties such as antimicrobial stewardship.
LAPSZÁM: MAGYAR UROLÓGIA | 2022 | 34. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Az elmúlt időszakban történtek olyan változások is napvilágot láttak olyan új információk az urogenitális infekciókkal, különösen a katéter/idegentest-viseléssel kapcsolatban, amelyeknek gyakorlati jelentőségük van és segíthetik az egyes osztályok és társszakmák munkáját egyaránt. Összefoglalónkat a Pécsi Tudományegyetem Urológiai Klinikájának adatbázisa és infekciókontroll gyakorlata alapján állítottuk össze az Európai Urológus Társaság (EAU) és az Amerikai Urológus Társaság (AUA) ajánlásait figyelembe véve. Részt vettünk a hazai, az országos tisztifőorvos által kibocsátott módszertani levél összeállításában is, amelynek témája a hólyagkatéterekkel összefüggő húgyúti fertőzések megelőzése.
Urológiai osztályokon az átlaghoz képest magasabb arányban fordulnak elő húgyúti idegen testekkel összefüggő valamint multirezisztens törzsek okozta uroinfekciók, amelyeknek népegészségügyi, infekciókontroll, és higiéniai vetülete egyaránt van, illetve olyan újdonságok működtetését tette szükségessé, mint az antimikrobiális állapotok felmérésére és elemzésére létrehozott statisztikai megfigyelő rendszerek (antimicrobial stewardship).
Bevezetés
Korábban úgy véltük, hogy a húgyutak sterilek, ez részint igaz, de a Covid-19-pandémiás időszak előtt már jelentek meg olyan kutatások, amik arról számolnak be, hogy valójában a húgyutaknak is lehet szaprofita flórája, jóval kisebb csíraszámban és a patogén kórokozóktól eltérő összetételű, amik a mikrobiológiai vizsgálatok során tenyésztéssel nem mutathatunk ki, de PCR-módszerekkel megtalálhatóak és igazolhatók. Ezek gyakorlati jelentősége még nem tisztázott, de alátámasztják azt az elméletet miszerint mi nem egy steril környezetben élünk, hanem szimbiózisban a saját baktériumflóránkkal, illetve egy egyensúlyállapotban, ami a húgyutak irányába történő folyamatos kórokozóinvázió és a szervezet védekezőképessége közt áll fent. Az infekciót ezen egyensúly állapot az invázió irányába történő felborulásaként kell értékelni. A húgyúti fertőzéseket rendszerint a saját bélflóránkban élő és a gáttájon, a bőrön is megtalálható baktériumflóra bejutása és túlszaporodása okozza a húgyhólyagban, majd a felső húgyutak szintjén. Szervezetünk részéről a védekező mechanizmusok főbb komponensei, a teljesség igénye nélkül, a húgyutakban az ürülés irányával ellentétben emelkedő húgyúti nyomás. A vizelet kiválasztása a vesékben uralkodó magasabb 40-70 H2O cm-es nyomásnál kezdődik. A húgyhólyagban már normális körülmények között max. 20-40 H2O cm-re csökken, míg a külvilágban 0. Ezt a kontinenciamechanizmusok és az antireflux-mechanizmusok biztosítják. A folyamatosan és nagy mennyiségben ürülő vizelet felhígítja és kimossa a kórokozókat. Az urothelium poliszacharid védőrétege igyekszik megakadályozni a baktériumok megtapadását. A vizelet hiperozmolaritása és alacsony pH-ja nem kedvez a kórokozók szaporodásának és ezek után egy bakteriális invázió során a humorális védekezéssel is számolni kell. A kórokozók ezzel szemben különböző virulenciafaktoraik segítségével igyekeznek bejutni a húgyutakba, behatolni az intercelluláris térbe, vagy csak megtapadni igyekeznek a nyálkahártya szintjén, de akár a húgyhólyagban is és igyekeznek a szaporodásukhoz megfelelő környezetet kialakítani. Ezt követően tudnak szöveti destrukciót, toxaemiát, bacteraemiát vagy szepszist okozni.
Logikusan következnek ebből a húgyúti infekcióra predisponáló tényezők, mint pl.: női nem, húgyúti obstrukció, anatómiai malformációk és olyan neurológiai kórképek, amelyek a húgyutak szintjén obstrukciót okoznak, kövek, idegen testek. Dehidratált állapotok, égés, hasmenés esetén is nagyobb a húgyúti infekció veszélye.
A húgyúti idegen testek, pl. a húgyhólyagkatéter, dupla J-stent, transrenalis drén, epicystostomia behelyezése ebbe az egyensúlyi rendszerbe történő durva beavatkozásnak számít és jelentősen növeli a húgyúti fertőzés kialakulásának esélyét, multirezisztens törzsek megjelenését.
A húgyhólyagkatéter behelyezésére a kórházban ellátott betegek körében 12-16%-ában kerül sor, urológiai osztályokon ez az arány lényegesen magasabb. A tünetes húgyúti fertőzés kialakulásának esélye statisztikai adatok alapján a katéterviselés minden napjával 3-7%-kal nő. A kórházban kezelt szeptikus állapotok második leggyakoribb oka a légutak után a húgyúti infekció. Napjainkban az uroszepszis halálozási aránya 10%, ami jelentős javulást jelent a 10-20 évvel ezelőtti 30-40% közötti állapotokhoz képest.
Éppen ezért kap hangsúlyos szerepet az urológiai műtétre kerülő, akár tartósan húgyúti idegen testet, katétert viselő betegek bakteriális spektrumának ismerete, a megfelelő antibiotikum alkalmazása a súlyos infekciók, szeptikus állapotok megelőzésére.
Betegek és módszer
A Pécsi Urológiai Klinikán műtétre érkező betegeknél elég gyakori a megelőző katéter- vagy más idegentest-viselés (stent, transrenalis drén). Az urológiai ellátás során pedig szinte mindenki visel valamilyen vizeletdeviálásra szolgáló katétert.
2018-ban vezettük be azt a gyakorlatot, hogy minden tervezett műtét előtt rendelkezzünk a betegek vizelettenyésztési eredményével, amit még ambuláns körülmények közt végeztünk el. A katéter, idegen test eltávolítása után ismételt vizeletbakteriológiai vizsgálatot végzünk az emisszió előtt. Anyagunkban a 2019 és 2020-as évben (Covid-19 előtti és az első Covid-19 év) végzett vizeletbakteriológiai vizsgálatok eredményeit dolgoztuk fel, kiemelve a multirezisztens kórokozókat (1. táblázat).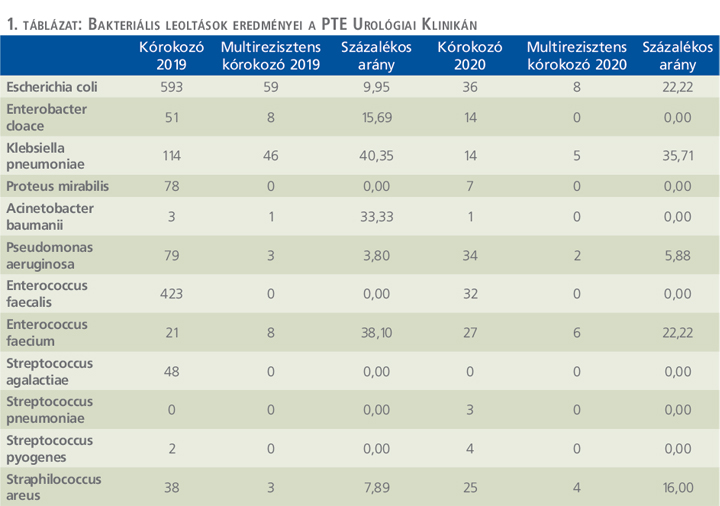
Az Európai Urológus Társaság (EAU) és az Amerikai Urológus Társaság (AUA) ajánlásait figyelembe véve az általunk végzett aktív surveillance eredményei és a kapott antibiotikumérzékenységek alapján perioperatív antibiotikumprotokollokat dolgoztunk ki. A tenyésztési eredményeket 3 havonta újra feldolgozzuk, és szükség szerint módosítjuk a protokollt (1. ábra).
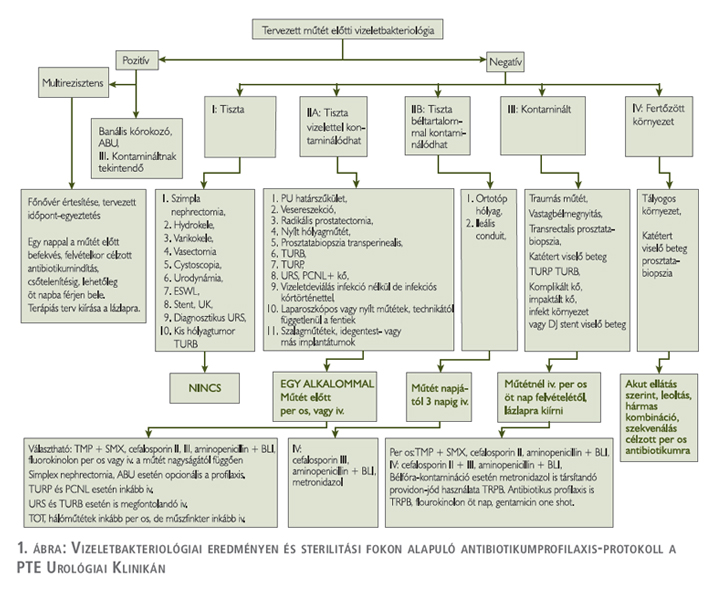
Negatív vizeletleoltás esetén a betegek rizikócsoporttól és műtéttípustól függően (tiszta-kontaminált vagy kontaminált) egyszeri, egy dózisú (one shot) perioperatív antibiotikumterápiában részesülnek parenterálisan vagy per os. Az antibiotikumválasztás empirikus, a survillance alapú protokolljaink alapján történik. A katétert/idegen testet viselő betegeink rendszerint pozitív vizeletleoltási eredménnyel jelentkeznek és perioperatív antibiotikumkezelésük célzottan és hosszabb ideig tart. Akár már otthon per os, vagy ha ez nem lehetséges, parenterálisan, a tervezett beavatkozás előtt legalább 24-48 órával kezdjük el és 5-7 napig folytatjuk a kezelést.
Eredmények
Az 1. táblázatban az Urológiai Klinikán bennfekvés során végzett vizeletbakteriológiai vizsgálatok eredményeit mutatjuk be. Ebben a táblázatban az akut betegek leoltásai és a tervezett műtétes betegek leoltásai szerepelnek. Csak a pozitív eseteket tárgyaljuk.
A 2020-as esetszámok drasztikus csökkenése a Covid-19 számlájára írható, lényegesen alacsonyabb fekvőbeteg-forgalom, műtéti szám miatt. Az előre tervezhetetlenség miatt a már rutinnak számító ambuláns vizeletleoltások egy része is elmaradt. Megfigyelhető viszont a multirezisztens esetek gyakoriságának növekedése, amit elsősorban a betegszelekcióval magyarázunk és nem a kórokozók virulenciájának növekedésével. A rendelkezések szerint súlyosabb állapotú, csaknem kizárólag onkológiai betegek kerültek a Covid-19 -pandémia alatt ellátásra.
Megállapítható, hogy a legtöbb húgyúti infekciót az E. coli okozta (több mint 40%). Ebből 10% volt multirezisztens kórokozó. Valamennyi multirezisztens törzs ESBL (kiterjedt-spektrumú b-laktamáz) termelő volt.
A második leggyakoribb kórokozó az Enterococcus fecalis volt. Ebben a csoportban viszont nem észleltük multirezisztens törzsek megjelenését. Az Enterococcus faecium esetén viszont szeretnénk felhívni a figyelmet a magas rezisztenciaarányra. A vancomycinrezisztens Enterococcus faecium aránya jelentősen emelkedik!
A Klebsiella pneumoniae és az Enterobacter cloacae törzsek előfordulása az előzőekhez képest alacsonyabb (kevesebb, mint 10%). Ugyanakkor fontos megjegyezni, hogy anyagunkban a Klebsiella törzsek multirezisztenciája eléri a 35-40%-ot, túlnyomóan ESBL és 1 KPC-termelő (Klebsiella pneumoniae karbapenemáz) fordult elő.
A 2019-ben 8 multirezisztens Enterobacter cloace közül 7 ESBL-termelő törzs volt, 1 viszont már carbapenemrezisztenciát is mutatott.
Multirezisztens Staphylococcus 3 esetben fordult elő. 2 esetben MRSA (meticillinrezisztens Sta. aureus), 1 esetben VRE (szerzett vancomycinrezisztenciával rendelkező Enterococcus) volt.
Antibiotikumprofilaxis protokolljainkat a 2. táblázat tartalmazza. Ezek következetes alkalmazásával sikerült a súlyos infekciók, szeptikus események számát csökkenteni valamint az antibiotikumkezelést költséghatékonyabbá tenni.
Megbeszélés
A húgyutak megnyitásával, illetve katéter, egyéb húgyutakba helyezett idegentest- (UK, szent) viseléssel járó műtétek esetén a húgyúti bakteriális kontamináció a 40%-ot is eléri. Megelőzően steril vizelettel rendelkező betegek esetén is indokolt a perioperatív antibiotikumprofilaxis a bakteriális kolonizáció megelőzésére. A cél az, hogy a műtét idején megfelelő szintű, a műtéti területen effektív szöveti koncentrációban legyen jelen a gyógyszer és hatásos legyen a várható kontamináns kórokozóval szemben (3).
Ismert adat, hogy ambuláns betegforgalomban a húgyúti infekciókat akár 80%-ban is E. coli okozza, ezt a mi anyagunk is igazolja. Megfigyelhető azonban, hogy a fekvőbeteg-ellátásban az E. coli mellett más bélbaktériumok előfordulási gyakorisága is jelentősen emelkedik az Urológiai Klinika populációjában, ez gyakran a katéter/idegentest-viselés számlájára írható. Az idegen test viselése más korokozók számára is növeli az invázió esélyét, visszaszorítva az E. coli szerepét. Az osztályos anyagban észlelt E. coli arány csak 40% volt.
Amíg az 1990-es években az urológián ellátott és katétert viselő betegeknél a Pseudomonas infekciók jelentették a legkomolyabb mikrobiológiai kihívást, addig láthatóan manapság az ESBL-termelő kórokozók okozzák a legtöbb problémát. A Pseudomonas továbbra is megtartotta a húgyúti katétereken biofilmképző képességét, viszont több antibiotikumcsoporttal szemben rezisztens Pseudomonas törzsek előfordulási gyakorisága nem növekedett, ezen betegeinket csak abban az esetben különítjük el, amennyiben multirezisztenciát észlelünk.
Manapság az ESBL-termelő Klebsiella és az E-coli fertőzések gyakorisága folyamatosan növekszik és kezelésükben nem ritkán tartalék antibiotikumnak számító carbapenemeket kell alkalmaznunk. A kezelés nehézsége az infekció recidiváló hajlamában rejlik, ugyanis rendszerint ezek a multirezisztens kórokozók a bélrendszert is kolonizálják. A parenterális antibiotikumkezelés rendszerint láz és műtéti beavatkozás esetén szükséges, viszont az infekciók kiújulásának megelőzésében a fent leírt elmélet alapján egy új szimbiotikus egyensúlyállapot, az aszimptomatikus bacteriuria elérése már megoldást jelenthet.
Ezen kórokozók mellett már látható, hogy a jövőben új kihívásokkal kell szembenéznünk, ez pedig pl. a vancomycinrezisztens Enterococcus faecium jelentheti. Az utóbbi pár évben ezen kórokozók okozta súlyosabb húgyúti infekciók kezelésére Magyarországon elérhető linesolidot használtunk, de már megjelentek igen drága új generációs antibiotikumok, IV. generációs cefalosporinok béta-laktamáz-inhibitorokkal kombinálva (6).
Számos olyan beteg fordul elő a klinikánk gyakorlatában, akiknél a rutin vizelettenyésztés során kimutatható a szignifikáns bacteriuria, de nincs tünetük, panaszuk (aszinptomatikus bacteriuria, – ABU).
Klinikai vizsgálatok igazolták, hogy menopauza előtti nők esetén a populáció 1-5%-a lehet érintett a húgyhólyagból történő tünetmentes baktérium ürítésében (1). Ez a szám 4-19%-ra emelkedik a menopauza után, a cukorbetegségben szenvedő betegek esetén akár 27%-ot is elérhet. Terhes nőknél 2-10%-ban figyelték ezt meg, továbbá szociális otthonban élő idősek, nők és férfiak körében egyaránt akár az 50%-ot is elérheti. Ezek általában, klinikai vizsgálatokkal igazoltan nem kezelendőek egy-két kivételtől eltekintve: nyálkahártya-sérüléssel járó urológiai eljárások előtt és terhességben. Ez a megállapítás multirezisztens kórokozók esetén is érvényes, sőt egyes megfigyelések szerint az ABU akár protektív hatású is lehet a súlyos húgyúti fertőzések megelőzésében kompetitív gátlás miatt (2).
Felmerül az a kérdés is, hogy szükséges-e a húgyúti idegen testet/katétert viselő beteget profilaktikusan antibiotikumkezelésben részesíteni? Megelőzhető-e ezzel a tünetes infekciók, multirezisztencia kialakulása? A válasz nemleges.
Az antibiotikumprofilaxis és húgyúti idegen test kérdését klinikai vizsgálatok sokféleképpen kutatták. pl. műtétek után egy-két hetes katéterviselés esetén az antibiotikumprofilaxisnak nem volt kimutatható előnye. Elhúzódó katéterviselés esetén végzett metaanalízisek minimális előnyt hoztak ki a profilaxisban részesülő betegek számára (ami viszont rendkívül változó volt), de az NNT-szám (number needed to treat) magas, 17 volt.
A jelenlegi klinikai ajánlás az Európai Urológus Társaság szerinti (erős szintű), hogy ne használjunk profilaktikus céllal antibiotikumkezelést és ez vonatkozik a katéter eltávolítása utánra is. Tünet nélkül megelőzés céljából nem szükséges az antibiotikumkezelés. Multirezisztens kórokozó és katéterviselés esetén a recidív infekciók megelőzése céljából viszont lehet alkalmazni profilaxist, ezt viszont javasolt urológiai vagy infektológiai szakrendelésen megtervezni (6).
Elterjedt gyakorlat az átmeneti katéterviselést követően a katéter eltávolítása előtt az úgynevezett „hólyagtréning”. A még korábbi rehabilitációs javaslatokra visszavezethető gyakorlat felett eljárt az idő, ma már nincs létjogosultsága. Jelen elmélet szerint csak a vizeletes pangást fokozzuk, növeljük az infekció esélyét, hatása viszont elégtelen (4, 5).
Kulcsfontosságú kérdés a megfelelő antibiotikum kiválasztása.
Az EAU ajánlása szerint, ha ismeretlen kórokozóval állunk szemben (urológiai, nem intenzív osztályon) az alábbi kombinációk javasolhatók komplikált UTI empirikus kezelése:
- amoxicillin és aminoglikozid;
- egy második generációs cefalosporin és egy aminoglikozid;
- egy harmadik generációs cefalosporin intravénásan.
A ciprofloxacint empirikusan csak akkor szabad használni, ha a helyi rezisztencia százaléka <10%, és ha a teljes kezelést szájon át adják, a betegek nem igényelnek kórházi ápolást, és a beteg allergiás a béta-laktám antimikrobiális szerekre (6).
Saját protokollunk kidolgozása során is ezeket az elveket alkalmazzuk a lokális bakteriális spektrum és rezisztenciaviszonyok ismeretéből nyert eredményekkel kiegészítve. Az antibiotikumrezisztencia helyi viszonyainak (antibiogram) ismerete elősegíti a kezdeti empirikus antibiotikumterápia megfelelő kiválasztását.
A kórházakban a felírt antibiotikumok 20-50%-a szükségtelen vagy nem megfelelő (7). Az is hibás gyakorlat, ha a súlyos betegnél késik a terápia, a széles spektrumú antibiotikum használata túl általános vagy a szűk spektrumú antibiotikum helytelenül kerül alkalmazásra, az alkalmazott antibiotikum dózisa magasabb vagy alacsonyabb, mint amire a betegnek szüksége van (vesetoxicitás!), az antibiotikumkezelés időtartama túlságosan rövid vagy túlságosan hosszú.
Válaszul a problémára egy világméretű kezdeményezés arra törekszik, hogy az antimikrobiális kezelési programokat beépítse az egészségügybe (8). Az Antimicrobial Stewardship célja a klinikai eredmények optimalizálása és a költséghatékony terápia biztosítása, miközben minimalizálja az antimikrobiális szerek használatának nem szándékos következményeit, például az egészségügyi ellátással összefüggő fertőzéseket, beleértve a Clostridium difficile-t, a toxicitást, a virulens organizmusok kiválasztását és a rezisztens baktériumtörzsek megjelenését.
Az EAU-nak is van hasonló programja, amelyet minden év novemberében prevalencia-alapon egy munkanapi adatok lekérésével folyamatosan bővítenek és felülvizsgálnak. A programhoz Magyarország is csatlakozott, hazai kollégáink is részt vesznek ennek szervezésében és kiértékelésében.
Megbeszélés
1. Anger J, Lee U, Ackerman AL, et al. Recurrent uncomplicated urinary tract infections in women: AUA/CUA/SUFU guideline. J Urol 2019; 202: 282–289. https://doi.org/10.1097/JU.0000000000000296
2. Cai T, et al. The role of asymptomatic bacteriuria in young women with recurrent urinary tract infections: To treat or not to treat? Clin Infect Dis 2012; 55: 771. https://doi.org/10.1093/cid/cis534
3. ECDC. Systematic review and evidence-based guidance on perioperative antibiotic prophylaxis. 2013.
4. Az országos tisztifőorvos módszertani levele a hólyagkatéterrel összefüggő húgyúti fertőzés megelőzésére, Budapest 2019.
https://www.antsz.hu/data/cms89838/Modszertani_level_a_holyagkateterrel_osszefuggo_hugyuti_fertozes_megelozesere.pdf
5. A Pécsi Tudományegyetem Klinika Központ a hólyagkatéterrel összefüggő húgyúti fertőzés megelőzésére vonatkozó eljárásrend.
https://aok.pte.hu/docs/csaladorv/file/Dr__Peterfi_Lehel_Urologiai_teendok.pdf
6. Bonkat G, Bartoletti R, Bruyere F, et al. EAU Guidelines on Urological Infections. https://uroweb.org/wp-content/uploads/EAU-Guidelines-on-Urologicalinfections-2020 pdf
7. Hulscher ME, et al. Antibiotic prescribing in hospitals: a social and behavioural scientific approach. Lancet Infect Dis 2010; 10: 167.
https://doi.org/10.1016/S1473-3099(10)70027-X
8. Dellit TH, et al. Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America guidelines for developing an institutional program to enhance antimicrobial stewardship. Clin Infect Dis 2007; 44: 159. https://doi.org/10.1097/IPC.0b013e318068b1c0