2019-1 —- Full Articles
Beszámoló az urológiai fekvőbeteg-ellátásról a 2017-es adatok alapján
DOI: 10.22591/magyurol.2019.1.boszormenyinagyg.18
Authors:
Böszörményi-Nagy Géza dr.
Bajcsy-Zsilinszky Kórház, Urológiai Osztály, Budapest (osztályvezető Böszörményi Nagy Géza dr.)
Összefoglalás
A Kollégium, a Társaság és a Magyar Urológia folyóirat összefogásával végzett adatgyűjtést 2012-ben kezdtük újra úgy, hogy az ez évi adatösszesítéssel már 6 év folyamatos adatszolgáltatásának eredményeit értékelhetjük. Maga az adatgyűjtés a korábban kidolgozott, egységes, elektronikus formában történik, így az értékelés gyorsabbá, könnyebbé vált. Az osztályok együttműködésének, az adatszolgáltató kollégák munkájának köszönhetően áll rendelkezésünkre tevékenységünk fontosabb mutatóinak és a műtéti statisztikánk összesítése. Köszönet érte valamennyi együttműködőnek, bár a határidők betartása még mindig nehézségekbe ütközött. A Magyar Urológia folyóirat éves első számában hagyományosan beszámolunk az éves műtéti statisztikai adatok összesítéséről
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 1. SZÁM

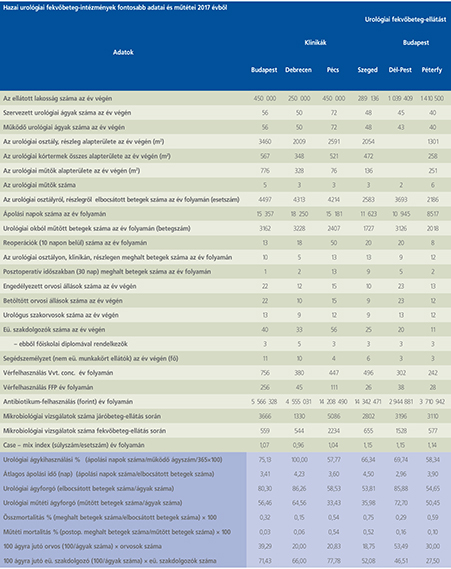
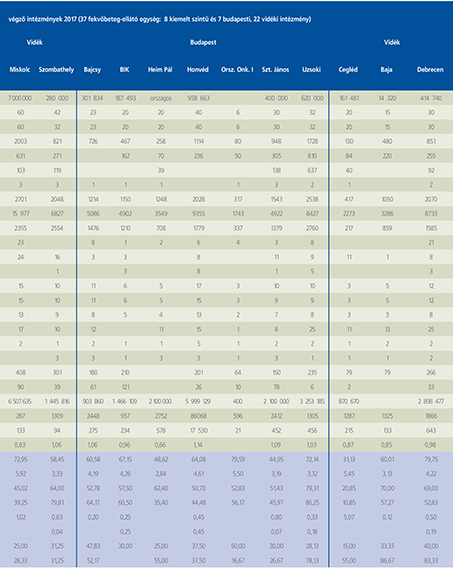
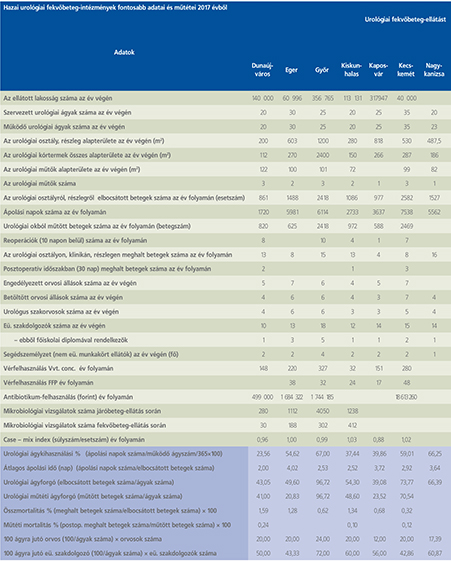
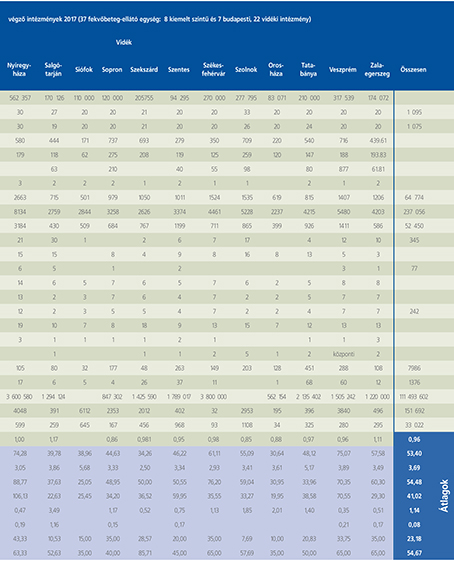
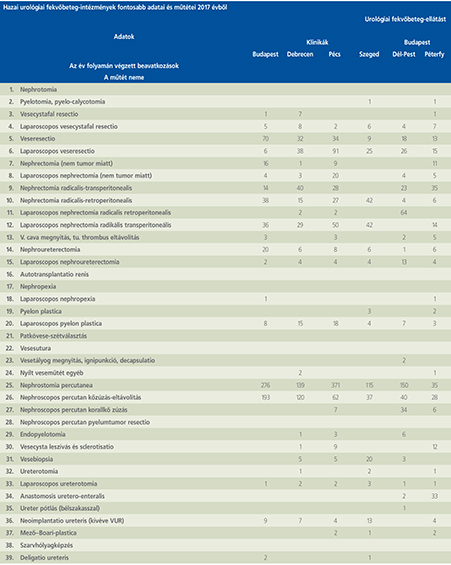
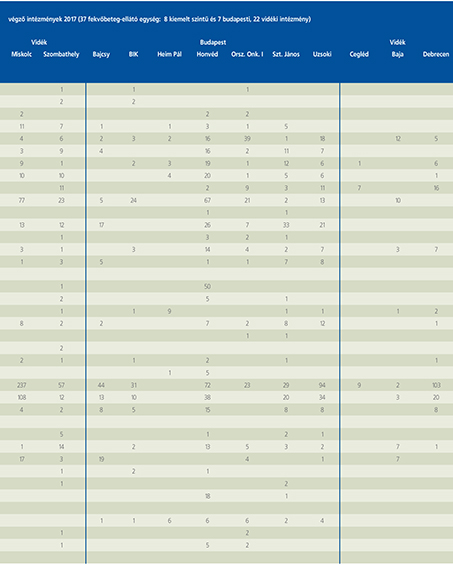
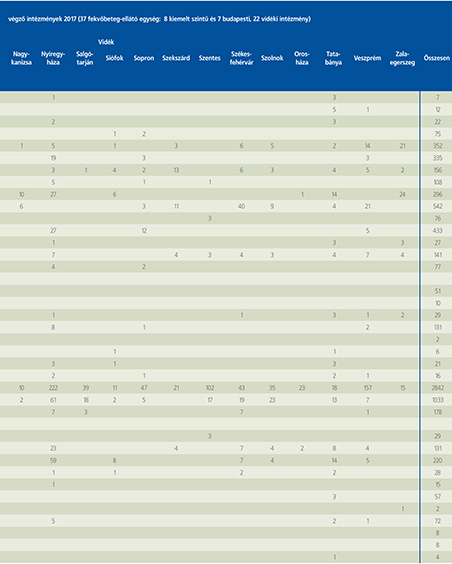
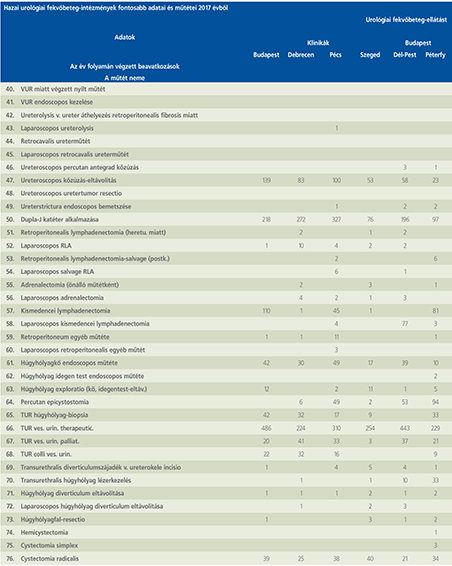
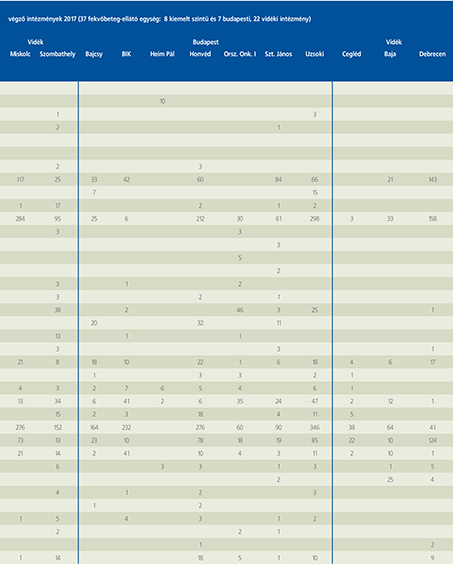
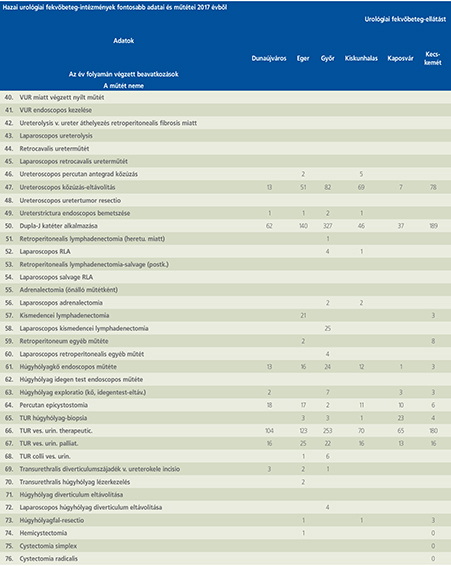
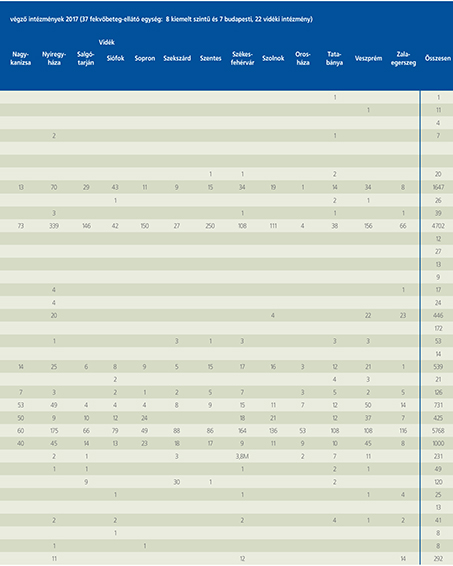
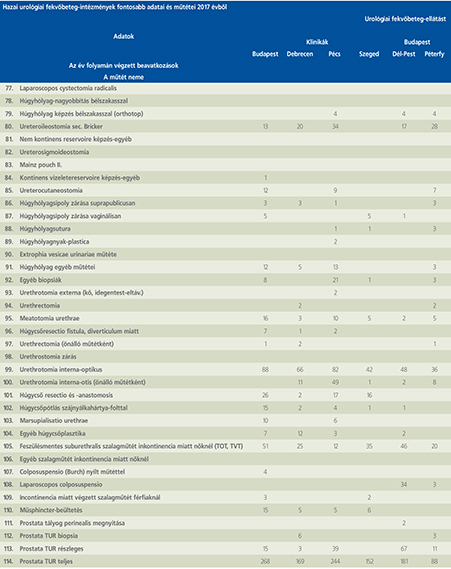
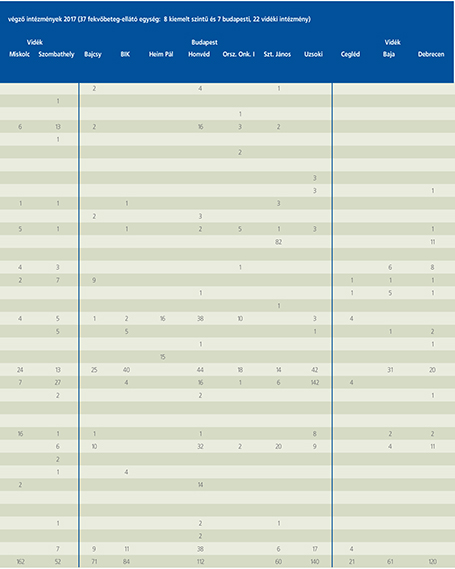
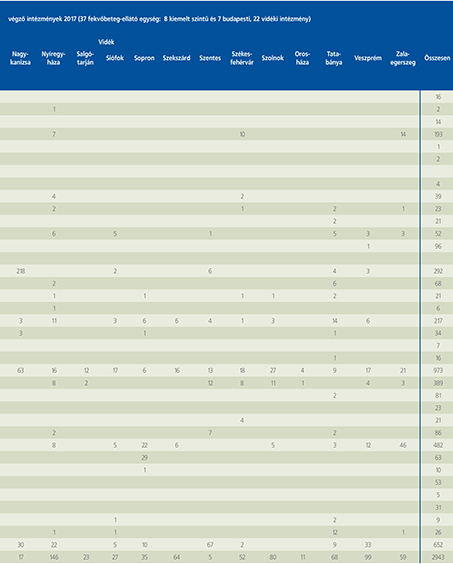
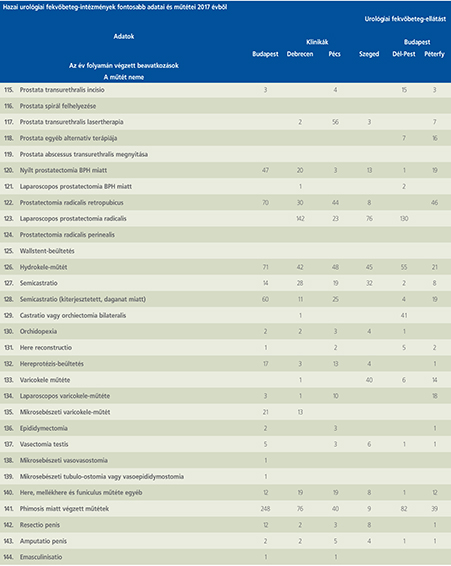
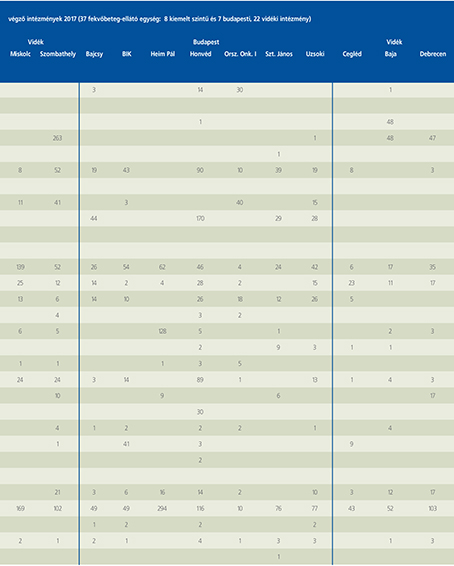
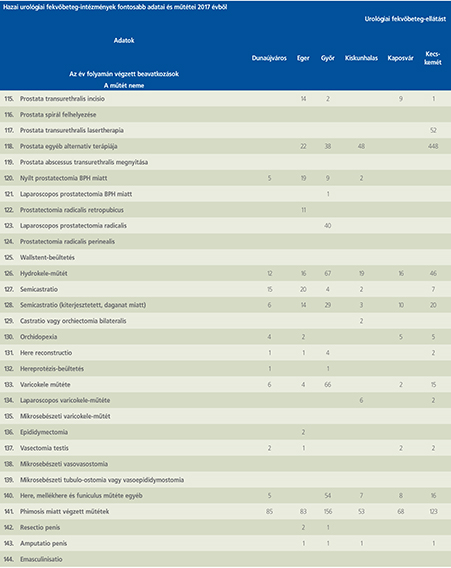
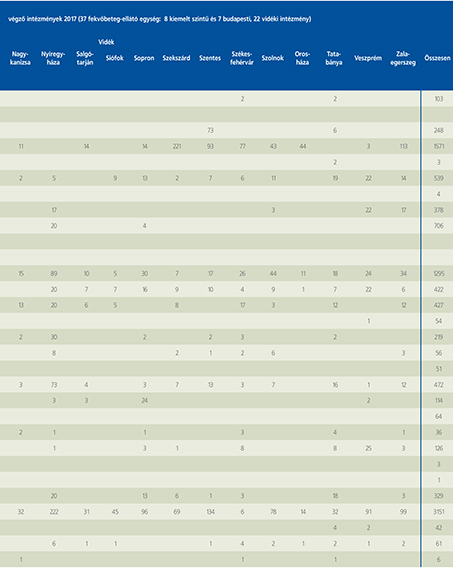
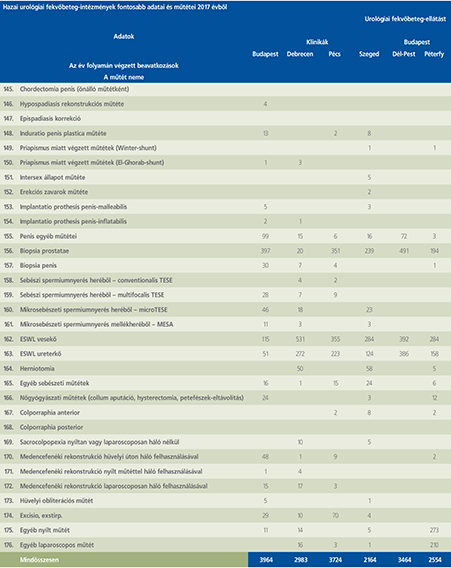
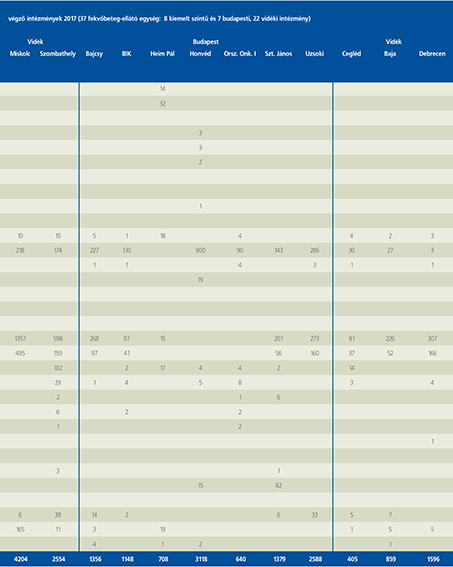
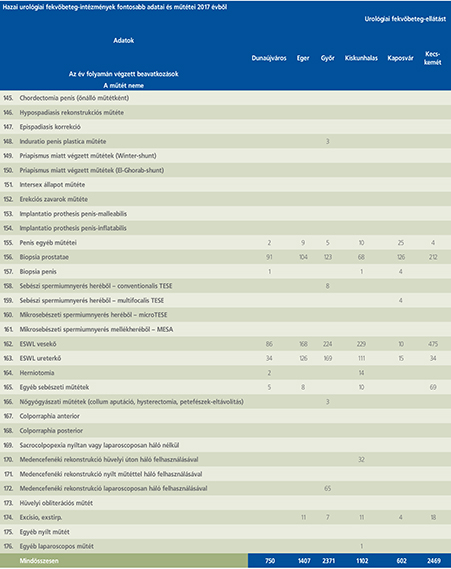
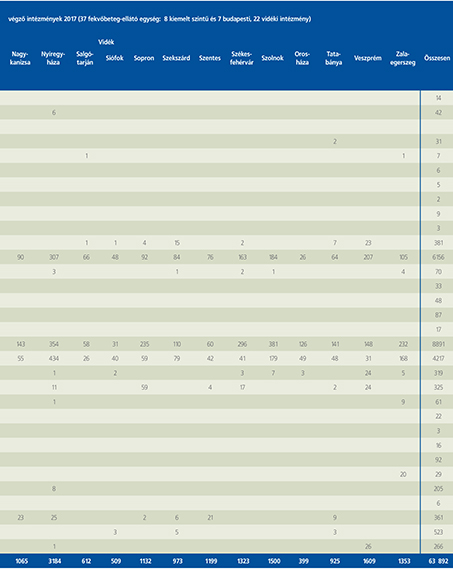
2016-ban a 38 hazánkban működő urológiai osztály adatait értékeltük, összesíthettük, ez 2017-re eggyel megint csökkent, a fekvőbeteg-intézmények száma 37. Ennek megfelelően csökkent a szervezett ágyak száma is, míg a case/mix indexünk tovább nőtt (1. táblázat).
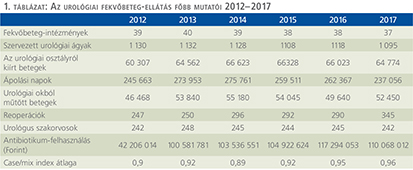
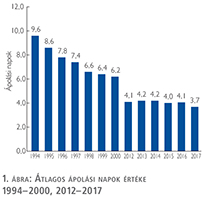
Az átlagos ápolási napok értéke 2012 óta stabilizálódni látszott, de 2017-ben jelentősen csökkent, 3,7 nap (1. ábra).
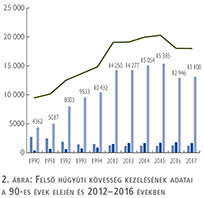
A felső húgyúti kövesség miatt végzett beavatkozások száma a múlt évi adatokkal csaknem egyező, az ESWL-ek nagy száma változatlanul meghatározza az összes beavatkozások számát (2. ábra).
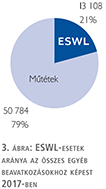
Az ESWL-esetek aránya az összes egyéb beavatkozásokhoz képest változatlanul 21% (3. ábra).
A percutan kőeltávolítások aránya csökkenő, az ureteroszkópiáké viszont – évről évre – növekvő tendenciát mutat az évek során.
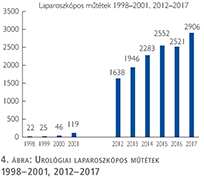
Az urológiai laparoszkópos műtétek száma ismét növekedett (4. ábra).
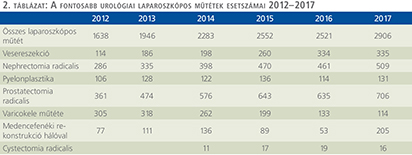
Szinte valamennyi laparoszkópos műtétből többet végeztünk, mint előző években (2. táblázat).
Növekedett a vesemegtartó-műtétek nephrectomiához viszonyított aránya, folytatódik tehát a tendencia, egyre több vesét tudunk megtartani.
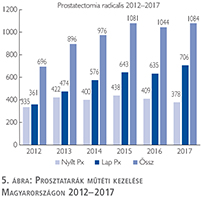
Csak kis mértékben, de növekedett a radikális prostatectomiák száma, a laparoszkópos prostatectomia aránya változatlanul emelkedik és az összműtéti szám változatlanul a lélektani 1000-es határ feletti (5. ábra).
Nem mutat viszont növekedést a radikális cystectomiák száma, 308 műtét történt.
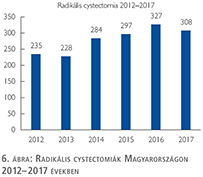
A vizeletelvezetések közül továbbra is szívesebben választottuk a Bricker-műtétet, az orthotop hólyagpótlások száma jelentősen visszaesett (6. ábra).
Összesítve, az adatokból látszik, hogy egyre kevesebb fekvőbetegosztály, egyre kevesebb ágyszámon, egyre súlyosabb eseteket lát el, egyre rövidebb ápolási idővel. Az urológiai laparoszkópia növekvő esetszámát is értékelve, úgy látszik, a magyar urológiai fekvőbeteg-ellátás minden nehézsége ellenére a korszerű irányba halad.
Ami az immár hatéves adatgyűjtést és értékelést illeti, szólnunk kell az annak hiányosságairól is.
Az adatbázisból hiányzik a szakrendelőkben, a magánellátásban végzett beavatkozások száma, nincs adatunk a szakmaidegen ellátásokról sem. Adatszolgáltatásunk hiányos a matrix osztályok növekvő száma miatt is, ahonnan sajnos nem kapunk meg alapvető adatokat, például a case/mix index értékét. Az adatbázis nem nyilatkozik a betegszámról, azaz csak esetszámokat regisztrálunk. Ennek különösen a köves betegek kezelésénél lenne jelentősége, hogy az újrakezelési arányokat megtudjuk.
Nem nyilatkozhatunk a szakmai minőségről és a költséghatékonyságról, bár indikátorok az adatokból meghatározhatók lennének.
További hiányosság, hogy adatbázisunkat, annak értékelését nem vizsgálja, nem használja fel sem szakmai grémium, sem finanszírozó, sem szakmapolitika.
Így – a 90-es évek gyakorlatától eltérően – visszajelzés a kórházak, intézmények vezetői felé nincs.
A statisztikai adatok értéke ettől függetlenül óriási. Lehetőséget nyújtanak saját tevékenységünk értékelésére, megerősíthetik, vagy megkérdőjelezhetik mindennapos gyakorlatunkat. Hazai és nemzetközi adatok összevetése válik lehetővé, előadásainkban végre hazai adatokra is hivatkozhatunk, nem csak külföldi epidemiológiai grafikonokra.
Remélhetőleg a munka folytatódik, és további adalékul szolgál urológiai tevékenységünk minél korszerűbb és hatékonyabb végzéséhez.


Tévedéseim, szövődményeim, tanulságok
DOI: 10.22591.2019.1.romicsi.12
Authors:
Romics Imre dr.
Semmelweis Egyetem, Urológiai Klinika és Uroonkológiai Centrum, Budapest (Igazgató: Nyirády Péter dr.)
Összefoglalás
„ A sikereket minden ember szívesen könyveli el, de a siker fénye megtévesztő. Elkápráztat, hatása múló, a kudarcok fájdalmai és tanulságai viszont tartósak. Jelentős sikertelenségeimnek időpontjait munkahelyi öltözőszekrényem ajtaján őrzöm, hogy naponta felhívják magukra a figyelmet.”
Széll K, Horváth B. Cipruslombok egy kortárs sírjára. Vasi Szemle 2008; 62: 131–152. (Idézve: Gaál Csaba: Anekdoták, adomák, érdekességek című könyvéből. Budapest: Medicina Könyvkiadó; 2009. 232.)
Széll Kálmán, a kiváló szombathelyi orvos szavai igazak. Sikerre vagyunk teremtve, mégis sikertelenségeinkre emlékszünk jobban. Közel tízezer műtét, 45 év sok mindent feledtet. De a rossz emlékek el sosem tűnnek. Néhány „sikertelenséget” okulásul közreadok.
A műtéti leírás, ha „egyszemélyes”, endoszkópos is többes számban írandó. Most azonban mindent egyes számban írok. Még ha a beteg gyógyításában társak, társzakmák, szakdolgozók is közreműködtek. A hibáért a felelős én vagyok!
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 1. SZÁM
- Úgy 1977-ben jobb oldali alsó harmad uréterkő miatt ureterotomiát végeztem. A röntgenfelvételen jól látszott a kő. A betegnek görcsei voltak. Urográfián vesében pangás volt. Nem volt kétséges az indikáció. A műtét másnapján, életemben először Jugoszláviába, a tengerpartra pöfögtünk Trabantunkkal.
Hazajövetelem után tudtam meg, mi történt a beteggel. A műtét után valamennyi idővel a betegnek alhasi fájdalmai, görcsei lettek. A kivett kő a beteg kezében volt. Appendicitis, gondolták; appendectomia történt. A beteg nem lett jobban. Röviden: a betegnek volt egy alsó kehelyköve is, ami korábban panaszt nem okozott. Ez mozdult ki, indult el, majd állt meg az ureterotomia helyén. Újabb ureterotomia történt.
Hazajövetelem után újranézve a röntgent, valóban volt egy halvány kőárnyék az alsó pólusban. Vagy nem vettem észre, vagy igen, de a kórlapba nem került be (mint nem lényeges melléklelet), ezért az itthon maradtak sem gondoltak újabb kőre.
Ha gondosabb vagyok, elkerülhető lett volna az appendectomia. - Kezdő urológus voltam, 70-es évek, ügyelet. Reggel 7 körül jött egy fiatalember jobb alhasi görcsökkel. Ilyenkor kapkod az ember, borotválkozna, reggelizne, kávézna… Felvettem a beteget gyorsan uréterkő-gyanúval a 11. kórterem 1. ágyára. Ultrahang nem volt, röntgen csak 8-tól. Rohanás, adjunktusi vizit, referáló, onnan a műtőbe kampózni. Dél körül kerültem ki a műtőből, gyanús lett, hogy a beteg nincs jobban. Sebészkonzílium, már feszülő has… Átvették, megoperálták.
A perforált gyomorból a gyomornedv csorgott le a jobb hypochondriumba. Ez okozta panaszait.
Valószínűleg az anamnézis-felvétel, fizikális vizsgálat nem volt megfelelő. - 1986–88 között a nyugat-németországi Bocholtban dolgoztam, néhány kilométerrel a holland határtól.
Az első vagy második héten – teljesen új fiú voltam, a környezet, nyelv, minden más volt – beosztottak asszisztálni. Egy holland orvosnak asszisztáltam. Ott a műtősnő izolált, mi csak a „leizolált” beteghez mentünk oda. Kisfiú cirkumcízió-műtétje szerepelt a programban. A gyermek kis hímvesszeje látszott ki a kendők között. Én nem láttam, hogy a gyereknek phymosisa lenne. Halkan mondtam: Herr Van de Velde – magázódtunk – én nem látok fitymaszűkületet. Bizonytalan lett, a falon levő beszélőkén át (Sprechanlage) szólt az osztályvezető-helyettesnek (a vezető Amerikában volt épp), hogy a „magyar” szerint nincs phymosisa a gyereknek. Röviden és keményen jött a válasz: azt kell operálni ami a programban van. Én, a keletről jött, új, hallgattam és megtörtént a műtét. Az izolálás levétele után vettem észre hogy az egyik scrotumfél üres… Orchydopexiát kellett volna végezni.
Talán erőszakosabbnak kellett volna lenni, félretenni a kisebbségi érzést. - 1991-ben újra kijutottam Bocholtba, az Oberartz elment főorvosnak, felvettek helyette egy volt „NDK-s”-t, aki mindennap 4 órakor – ha volt munka, ha nem – hazament. Próbaideje után nem hosszabbította meg alkalmazását volt főnököm. Így jutottam ki a helyére 4 hónapra a fenti pozícióba. Ezalatt főnököm sokat utazott, síelt, élvezte, hogy a telefonügyeletet 4 hónapra átvettem. Egy alkalommal veseciszta-műtét volt kiírva. Akkor még operáltunk, nyíltan. Egy kórházban dolgozónak a férje volt a beteg. Már aludt, amikor kisült, nincs aláírva a beleegyező nyilatkozata. Döntenem kellett mi legyen, ott Németországban. Nem mertem reszkírozni, felébresztettem, másnap operáltuk.
Hiba: nem ellenőriztem a dokumentációt. - Ugyancsak ebben az időben történt, hogy egy hydrokelét operáltunk, asszisztáltam egy AIP-nek (Arzt in Praktikum). Talán rezidensnek felel meg itthon. Nagy hydrokelezsák volt, reszekálni kellett. Nyilván ügyetlenül asszisztáltam, a fiú egy ollócsapással átvágta a ductust. A férfi 60 év körül volt, megértette, de nem örült neki.
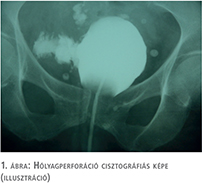
Rosszul asszisztáltam. - Még 1986-ban történt. 39 éves voltam. Korábban még nem csináltam Magyarországon hólyagtumor-reszekciót. Az első ilyen műtétet ott, Németországban végeztem. Naná, perforáltam a hólyagot. Nem kellett feltárni. A főnök külföldön volt, a nálam fiatalabb, de jobban operáló helyettese, aki a keletieket úgy en bloc nem kedvelte, jól leszúrt. Pár nappal tovább volt bent a katéter (1. ábra).
Én perforáltam. De akkoriban én (és hazai kortársaim) miért is csak 39 évesen TUR-oztunk először…? - Pestlőrincre jártam másodállásban az SZTK-ba délutánonként a 70-es évek végén. Az Urológiai Klinikáról jártunk ki hárman és láttuk el a XVIII., XIX. kerület és Vecsés betegeit. Csak délután. Hosszú, tömött sorokban álltak a betegek a folyosón. Volt egy jóval 100 kiló feletti hölgy, mindig bundában, kipirosítva, mint aki majd kicsattan az egészségtől, és vele 50 kg-os alacsony kis férje (Stan és Pan). Vizelési panaszai voltak a hölgynek, de sose volt neki jó semmi, nem javult, „nyafogott”. Részletekre nem emlékszem. Nyilván volt vizeletvizsgálat, antibiotikum-kezelés. Ez persze tartott tán hetekig is. Egyszer említette, hogy hőemelkedése is szokott lenni. Rájöttem, tán nem a púdertől piros az arca. Urográfiát végeztem. Típusos tbc-jelek, bunkós kehelyvégek. Tenyésztés pozitív, onnan már egyenes út volt a gyógyulásig.
Lehet nyafkának tűnő, feltűnően öltözködő nő is súlyos beteg. - Az ORFI-ban (ma Irgalmasok) voltam főorvos 1995 és 1997 között. Felvettünk egy 40 év körüli férfit, feleségem rokonát haematuria miatt. A főváros nagy urológiájának vezetője tükrözte ambulanter. Megállapította, hogy a jobb szájadékból vérzik. Erre az oldalra fixáltunk, ultrahang, urográfia, CT és angiográfia is történt, de a vérzés okát nem találtuk. Nem tükröztük újra, a kolléga ítéletében megbíztam.
Mígnem egyik reggel a beteg szája is vérzett. Belgyógyász, hematológiai konzílium következett. A diagnózis: myeloma multiplex. Belehalt.
Nyilván, amikor a kolléga tükrözte AKKOR vérzett jobbról. A bal uréterben talán egy koagulum miatt nem. Ha még egyszer megtükrözöm? Az egész bentfekvése tán két hetet késleltette a korrekt diagnózist, nem emiatt hunyt el.
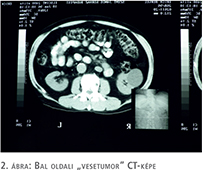
De megmaradt bennem, és mindig mondtam kollégáimnak is, ne felejtsék el: „AKKOR”. - Ugyancsak az ORFI-ban történt. Belgyógyász kísért át hozzám egy beteget. Férfi, 60 körüli. Törte a magyart. Brassói szász, neves dirigens, számon tartott Brahms-interpretátor. Sokáig és sok helyen élt külföldön, mostani felesége magyar, és Budára költöztek. Makrohematuriája volt. Az IVP és a CT bal oldali vesetumort látszott igazolni (2. ábra). Nephrectomiát végeztünk. A feleség sebész testvére ott volt a műtétnél. Míg mi jókedvűen zártuk a beteget, ő az előtérben felvágta a vesét. Bejött és mondta, nincs a vesében tumor. Ilyenkor mire gondol a sebész, süllyedő vérnyomás mellett: rossz oldalt operálok! Szörnyű érzés, de a szemben kiakasztott röntgenképek megnyugtattak. Részben. Majd a patológus megtalálja-gondoltam. De a tumor 4 cm-es volt, tehát annak látszani kellett volna. Hólyagtumora van – gondoltam, és onnan vérzik. És biztos én vagyok a hibás, nem gondoltam rá. Megtükröztük pár nap múlva. Nem volt hólyagtumora. Sebe rosszul gyógyult, a fonalak (vagy ahogy ő nevezte, a funárok, emlékeztetve a magyargyűlölő kolozsvári polgármesterre) jöttek ki. Házhoz kijártam kötözni, a közelben laktak. Sokat mesélt börtönéveiről a Duna-deltában, a Ceausescu-pribékekről; egy saját foga sem volt a verések következtében. Aztán meggyógyult. Németországba költöztek. Nincs vége a történetnek. Évekkel később hívott a korábban a klinikán dolgozó Galamb László főorvos Bajorországból, hogy mit tudok a művész úrról, merthogy nála fekszik prosztatarák miatt, tele van csontáttétekkel. Már a klinikáról rohantam vissza az Irgalmasokhoz. Kikerestük a kórlapot, hátha elnéztünk egy prosztatarákot – bár az a hematuriát nem magyarázná.
Nem volt gyanú prosztatarákra a kórlap szerint.
Újranézve a CT-képeket, az a tumor talán csak egy ciszta volt. Azt meg műtét közben kipukkasztottuk, kipukkadt, nem volt lényeges. A hibát ott követtem el, hogyha műtét közben nem találom a tumort nem kellett volna kivenni a vesét. Makrohematuria, és tumort leíró CT-lelet mellett ne vegyem ki a vesét? Vagy ha reszekciót tervezek? Ez 25 éve nem volt még egyértelmű és ajánlott trend.
Még ma sem tudom miért volt hematuriája. - Egy Bricker-hólyaggal, hasán egy vizeletes zacskóval keresett fel a 90-es évek végén egy kamionsofőr.
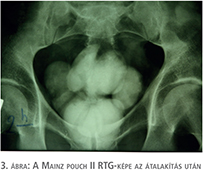
Zavarta a zacskó a hosszú utakon, ami természetes. Már nem tudom, hol történt a cystectomia, de a mindmáig megőrzött CT-n hólyagdaganat látható. Úgy döntöttem, konvertálom és egy Mainz II típusú rezervoárt készítünk, ami miatt ülve kell vizelnie a betegnek, de legalább nyáron, melegben nem kell a hasán zacskót hordani.
A műtét menete a következő volt. Az urétereket levágtuk a Bricker-féle kirekesztett ileumról és a kirekesztett ileumot ráborítottuk, mint egy sapkát a felvágott, összehajtott sigmára. Az urétereket a sigmába neoimplantáltuk. (Miért nem hagytuk a sigmatasakon, nem tudom.) A hasán a bőrt, ahova a Bricker volt szájaztatva bevarrtuk. Egyszerű leírni, de a drénen keresztül napokig jött a vizelet. Urográfia, cisztográfia, kolonoszkópia – semmi nem magyarázta. A beteg ázott. Aztán az újabb feltárás után kiderült: a két urétert ugyan levágtam az ileumkacsról, de csak az egyik, a vékonybél felé eső urétervéget kötöttem le. A másikat elfelejtettem.
A beteg ezután még sokáig vezetett kamiont zacskó nélkül (3. ábra).
- Jó tíz éve végeztem egy hydrokeleműtétet. Valami nagyon nyomasztott – előfordul ez osztályvezetőkkel – és nem figyeltem eléggé a műtétre. Egy friss műtősnővel ketten operáltuk. Ő nem ismerte a Winkelmann-műtétet, adta kezembe, amit kértem. A bőr bevarrása után jöttem rá, hogy a hereburkokat nem a here mögött, hanem előtte varrtam össze. Azaz, kiengedtem a savós folyadékot és visszavarrtam, ahogy volt. A beteggel máshonnan is ismerjük egymást, évente megkérdezem tőle, hogy van. Nincs hydrokeléje, meggyógyult.
És a műtéttani könyvek ehhez mit szólnak…? - Veseműtétet végeztem. Úgy 15 éve. Talán pyelonplasztika volt. Szokás szerint a rezidens varrta be a sebet, beraktuk a drént, bőrhöz kiöltöttük. Pár nap múlva venném ki a drént. Nem jön. Próbálok ollóval benyúlni, vágni. Hiába. A fiatal hölgy, valakinek a valakije volt, egyágyas szobában, nagyon dühös volt, ígért sok mindent – jót nem – annak, aki az izomöltésbe bevarrta a drént. Persze mondtam, én voltam. Újra altattuk, a sebet részben kibontottam, a drént kivettem, újra összezártam. Amikor ébredezett egy nagy csokor rózsával álltam az ágya előtt.
Ja, a klinika jó hírének megőrzése elsősorban a főnök feladata. - Az első – a klinikán töltött – tíz év alacsony műtéti száma miatti számításaim szerint most járok a tízezer közelében vagy akörül (Babics több mint húszezret operált.) Egy betegem halt meg műtét közben. A beteg, 70 év körüli nő, 20 kilogramm fogyás után ment orvoshoz. Hatalmas vesetumora volt (4. ábra).
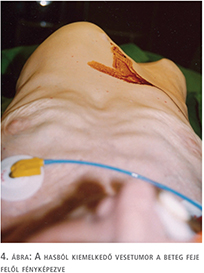
Volt/van oldalirányú felvétel is, amin egy 8 hónapos terhességnek megfelelő has domborodik (nem találom a fotót).
A vena cava is ki volt töltve thrombussal, közel emberfejnyi volt a tumor. A sok parazita véna miatt vérzett is, a cavat is megnyitottuk, a műtét sokáig is tartott. A műtét végére – már a bőrt is bevarrtuk – a keringése összeomlott. A kiváló aneszteziológus, szívmasszázs, transzfúziók sem segítettek. A beteg meghalt.
Igazságügyi boncolást kértem magam ellen. Petyhüdt szívet, belszervi eltéréseket találtak, műtéti hibát nem. De ennek ellenére ezt nem, ezt sem felejtem el, míg élek.
Nyilván hasonló esetek mással is előfordultak. Egyiknek nagyobb, másiknak kisebb tanulsága van. Csak annak nincs szövődménye, aki nem operál – szokták mondani. Időnként be kell vallani. Vannak, akik szerencsésebbek, ügyesebbek és ilyen dolgozat megírásához nincs esetük.
Hátha valaki tanul más hibáiból is.
Gender affirmation metoidioplasty in female to male gender dysphoria – results of six patients
DOI: 10.22591/magyurol.2019.1.bordasn.8
Authors:
Bordás Noémi dr.1,2, Vladimir Kojovic dr.2, Marta Bizic dr.2, Borko Stojanovic dr.2, Miroslav L. Djordjevic dr.2
1Kiskunhalasi Semmelweis Kórház, Urológiai osztály, Kiskunhalas (osztályvezető: Holman Endre dr.)
2Belgrade Center for Genital Reconstructive Surgery, Belgrád, Szerbia (osztályvezető: Miroslav L. Djordjevic dr.)
Summary
Objectives: Metoidioplasty represents a technique for creating a neophallus from clitoris, in female to male (FtM) transsexuals. This article provides an overview of methods and the indications, possible complications, essential steps of the metoidioplasty procedure, our Hungarian patients’ results and some aspects of postoperative care.
Material and methods: Between 2014 and 2018 six Hungarian patients were operated by our surgical team. Belgrade type metoidioplasty were performed in all cases. Surgical inclusion criteria of Standards of Care Version 7 of World Professional Association for Transgender Health were followed.
Results: Mean follow up was 26 months (range from 4 to 56 months). Mean hospitalization was 3 days (range from 2 to 5 days). All patients had good postoperative outcomes, preserved sensation of the neophallus, and they all void in standing position. Rate of urethral fistula was 33%.
Conclusion: Metoidioplasty can be a good alternative of total phalloplasty in selected patients. As a one-stage procedure, Belgrade metoidioplasty includes lengthening and straightening of the clitoris to make a neophallus, urethral reconstruction to enable voiding while standing, and scrotal reconstruction with insertion of testicular implants.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Célkitűzés: Nőből férfi (FtM) tanszneműség esetén, metoidioplasztika elvégzésével a clitorisból neophallus képezhető. A szerzők célja a módszerek, indikációk, lehetséges szövődmények, műtéti alaplépések, eredményeik és néhány posztoperatív szempont bemutatása.
Anyag és módszer: 2014 és 2018 között sebészeti munkacsoportunk 6 magyar beteget operált. Minden esetben Belgrád-metoidioplasztika történt. A páciensek a World Professional Association for Transgender Health Standard of Care 7. verziójának sebészeti kritériumrendszerének megfeleltek.
Eredmények: Az átlagos követési idő 26 hónap volt (4–56 hónap). Az átlagos hospitalizáció időtartama 3 nap volt (2–5 nap). Minden beteg esetében a posztoperatív eredmények jók, a neophallus érzékeny és a páciensek mindegyike képes állva vizelni. Anyagunkban húgycső-sipoly 33%-ban alakult ki metoidioplasztika elvégzése után.
Következtetések: Válogatott beteganyagon a metoidioplasztika jó alternatívája lehet a totál phalloplasztikának. Az egylépcsős Belgrád típusú metoidioplasztika esetében a clitoris megnyújtása és kiegyenesítése, valamint húgycső-rekonstrukció történik, amely az állva vizelést biztosítja, illetve ezzel egy időben a herezacskó rekonstrukciója is kivitelezhető here implantátumok behelyezésével.
Bevezetés
A metoidioplasztika egy egylépcsős nemi megerősítő műtéti lehetőség nőből férfi (FtM) transzszexualizmus esetében. A beavatkozás lehetővé teszi a többlépcsős komplex phalloplasztikák elkerülését. A betegek pontos igényeinek felmérése, a gondos beválogatás és tájékoztatás elengedhetetlen nemi megerősítő sebészeti beavatkozások tervezése előtt. Metoidioplasztika során az alkalmazott technikát egyaránt befolyásolják a páciensek anatómiai adottságai, a rendelkezésre álló szövetek minősége és a betegek preferenciája. Alapvető cél a jó kozmetikai eredmény, az állva vizelés biztosítása, valamint a szexuális funkciók megőrzése és/vagy fokozása. Természetesen a metoidioplasztika során képzett mikropénisz a közösülésre nem vagy igen ritkán alkalmas. Azonban jól válogatott beteganyagot vizsgálva, a műtöttek többsége a nemiszervük férfias küllemével, a vizelési és szexuális funkcióikkal elégedett lehet, vagy elégedettségük nagyban fokozható, amely nemi dysphoria érzésük és szociális beilleszkedésük, életminőségük és párkapcsolatuk szignifikáns javulásához vezethet.
Anyag és módszer
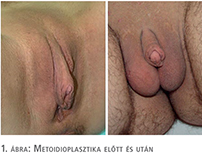
2014 és 2018 között a munkacsoportunk 6 metoidioplasztikát végzett el magyarországi betegeken a Belgrádi Transzegészségügyi és Genitális Rekonstrukciós Sebészeti Centrumban. Minden beteg a WPATH (World Professional Association of Transgender Health) transzegészségügyi standardok 7 verziója kritériumrendszerének megfelelt, valamint érvényes pszichiátriai, klinikai szakpszichológiai véleményekkel és minisztériumi engedélyekkel, új anyakönyvi kivonatokkal rendelkeztek. A betegek mindegyike szisztémás és lokális hormonterápiában, valamint vákuum terápiában részesült. Minden esetben egyedi műtéti tervezés és kivitelezés történt. Minden betegnél „Belgrade metoidioplasztiká”-t végeztünk (1. ábra). A bilaterális mastectomia, hysterectomia és adnexectomia minden páciens esetében a metoidioplasztikát megelőzően történt más intézetben. Metoidioplasztikával egy időben 4 betegnél történt mellkas-korrekciós esztétikai műtét.
A Belgrade metoidioplasztika leegyszerűsített alaplépései:
- vaginectomia vagy colpocleisis,
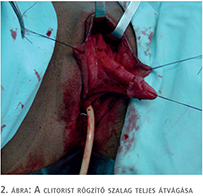
- metoidioplasztika (clitoris-rekonstrukció: kiegyenesítés és hosszabbítás) (2. ábra),
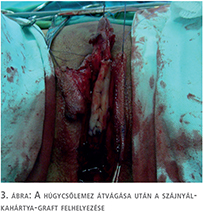
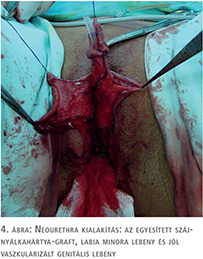
- húgycső-rekonstrukció (szájnyálkahártya és lokális bőrlebenyek kombinált felhasználása) (3–4. ábra),
- scrotoplasztika és bőrrekonstrukció,
- hereimplantátumok behelyezése (5. ábra).
Eredmények
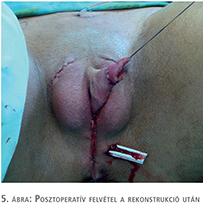
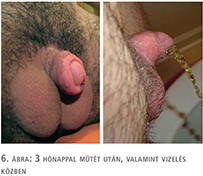
A műtétek utáni átlagos követési idő 26 hónap (4–56 hónap). Az átlagos hospitalizáció 3 nap (2–5 nap). A műtét során behelyezett dréneket átlagosan a 3. napon, húgycső-stentet a posztoperatív 10. napon, míg az epicystostomás csövet 3 hét után távolítottuk el. Minden beteg képes állva vizelni a műtétet követően és az erotikus szenzáció minden esetben megtartott (6. ábra). A betegek nem bánták meg a műtétet, a kozmetikai eredményekkel mindannyian elégedettek. Húgycsősipoly 3 esetben alakult ki, egy esetben spontán gyógyult és 2 beteg (33%) esetében sipolyzáró műtét volt szükséges. A hereprotézisek pozíciójának aszimmetriája 1 esetben alakult ki, de a beteg az aszimmetria műtéti korrekcióját nem óhajtotta. További major szövődményt nem észleltünk. Kiegészítő mellkaskorrekciós eredményekkel az érintettek elégedettek voltak, mellkas műtéti sebek szövődmény nélkül gyógyultak. Minden beteg esetében a képzett pénisz posztoperatív vákuum terápiáját javasoltuk.
Megbeszélés
A nemi megerősítő műtétek eredményességének egyik kulcsa a precíz betegszelekció, valamint az egységes kritériumrendszerek alkalmazása. Mind a pszichológiai mind a pszichiátriai vizsgálatok célja, hogy kóros pszichopatológiai történéseket azonosítsanak és a nemi identitás stabilitását, valamint a transzneműség dominanciáját vizsgálják. A pszichológus általában részletes személyiségelemzést végez tesztek alapján (pl.: Roschach, MMPI). Mindkét véleménynek meg kell erősítenie a transzneműség diagnózisát (F6400: transzszexualizmus) és nyilatkoznia kell arról, hogy egyéb mentális zavar vagy pszichiátriai betegség tünetei észlelhetőek-e, amelyek a döntések meghozatalában korlátoznák a pácienst vagy kezelést igényelnek. Mindemellett a vélemény tartalmazza, hogy a nemi megerősítő beavatkozások, hormonterápia és a névváltás a beteg életminőségét nagyban javítanák, így a tervezett procedúráknak pszichológiai és pszichiátriai ellenjavallata nincs.
A részletes betegtájékoztatást követően tapasztalatunk alapján a metoidiopkasztika műtét relatíve népszerű FtM transzneműség esetén, bár a magas költségek miatt a magyar betegek számára sokszor nehezen hozzáférhető. E műtét mellett dönthet olyan személy, aki például tartós kapcsolatban él és a nemi örömszerzés egyéb formáival teljesen elégedett (más erogén zónák izgatása, orális szex stb.) – hiszen az orgazmuskészség megmarad a metoidioplasztika után is, mivel a clitorisból képzett glans és a felhasznált lokális lebenyek érzékenysége megtartott. Választhatja az is, akinek nincs partnere és nem is tervez párkapcsolatot; választhatja az is, aki homoszexuális kapcsolatban kíván élni és anális szexet folytat (hiszen a transzneműség nem azt jelenti, hogy minden transznemű személy heteroszexuális kapcsolatot keres a nemi megerősítés után). Továbbá sokaknak riasztóak a phalloplasztika műtét szövődményei, a kockázatok, idegenkednek a péniszimplantátumoktól, taszítja őket az esztétikai eredmény, nem akarnak sorozatos műtéteket és nem utolsó sorban esetleg nincs is erre pénzük, de az egylépcsős metoidioplasztikát kedvező alternatívának tartják. Sokan csak átmeneti megoldásként tekintenek a metoidioplasztikára, majd későbbiekben tervezik a phalloplasztikát (anyagi megfontolás vagy tartós partnerhiány).
A metoidioplasztikát először Lebovic és Laub említették (1) közleményükben a phalloplasztika egylépcsős alternatívájaként. A húgycső meghosszabbításától függően e 3-8 cm-es képzett pénisz a genitáliák realisztikus megjelenését, az állva vizelést, az erotikus szenzációk megtartását képes biztosítani a betegek számára. A penetrációra való alkalmassága elmarad a phalloplasztika során képzett pénisztől, a közösülésre alkalmas neophallus ezzel a technikával kevésbé vagy nem képezhető. Nagy előnye azonban a lokális szövetek felhasználása miatt a természetesség, szexuális spontaneitás és erotikus szenzáció megőrzése. Kellően szelektált és motivált betegek kezelésekor a phalloplasztika alapvető hátrányai kiküszöbölhetőek vagy nagymértékben csökkenthetőek metoidioplasztika választása esetén – mint például a magas költségek, több lépcsős beavatkozások, hosszú műtéti idő, nagy műtéti rizikó és szövődményráta, protézisek nehéz kezelhetősége és meghibásodási lehetősége, szexuális spontaneitás elvesztése, donor területtorzító és nem esztétikus hegei stb. (2). A magas BMI-index, kedvezőtlen testalkat, vagy a hormonterápiára adott limitált válaszkészség negatívan befolyásolják a metoidioplasztikák eredményességét. Néhány plasztikai sebészeti manőver, lokális hormonkészítmények vagy vákuumterápia alkalmazása javíthatják az elégedettségi mutatókat és a szövődmények arányát. A nemzetközi irodalom alapján a szexuális elégedettség mind a metoidioplasztika, mind a phalloplasztika esetében magas (3). A metoidioplasztika utáni phalloplasztika aránya egy tanulmány szerint 13,52% (4).
A metoidioplasztika több technikája ismert. Történhet egyszerűen az urethra extenziója nélkül (egyszerű metoidioplasztika) vagy népszerűbben az állva vizelést lehetővé téve a húgycső meghosszabbításával (ring metoidioplasztika, Belgrade metoidioplasztika) (5, 6). A neourethra képzéséhez számos lokális lebeny (genitális bőr, illetve mucosa lebenyek, hüvelyi lebenyek) és más graftok (például szájnyálkahártya) felhasználhatóak. A képzett pénisz bőrét általában lokális lebenyek felhasználásával alakítják ki. A metoidioplasztikát gyakran egy lépésben kombinálják más beavatkozásokkal: hysterectomia, oophorectomia, vaginectomia, scrotoplasztika, hereimplantátum behelyezés és más plasztikai sebészeti és esztétikai műtétek. A szövődmények kockázata a műtét komplexitásának növekedésével egyértelműen fokozódik, de még az egyszerű metoidioplasztika esetében is nagy műtéti tapasztalattal rendelkező sebészeti munkacsoport választása javasolt. A posztoperatív komplikációkat csoportosíthatjuk minor (pl.: haematoma, infekció, kisebb bőrnekrózis, húgyúti fertőzés, enyhe vizelési panaszok, kis húgycsőfisztulák) és major szövődmények (pl.: nagyfokú bőrnekrózis, fisztulák, húgycsőszűkület, implantátum-elmozdulás vagy kilökődés) szerint. Utóbbiak esetében további műtéti korrekciók szükségesek. Az irodalmi adatok szerint a szövődmények aránya 17,5% és 35% között változik (4, 7, 8, 9).
Következtetések
FtM transzszexualizmus esetén nemi megerősítő műtéti lehetőség a metoidioplasztika, olyan betegek számára, akik férfias külső genitáliákra törekszenek, de elfogadják azt, hogy képzett péniszük méretei a felnőtt átlagos méretektől el fognak maradni. E műtét lehetőséget teremt a többlépcsős phalloplasztika elkerülésére. Jól válogatott beteganyag és tapasztalt munkacsoport esetén a funkcionális és pszichoszexuális eredmények jók. A megfelelő preoperatív tervezés, előkészítés, felvilágosítás, anatómiai és rekonstrukciós ismeretek elengedhetetlen tényezők a sikeres műtétekhez. A metoidoplasztikák jelenlegi technikai lehetőségeivel esztétikus képzett pénisz alakítható ki, amely az állva vizelést biztosítja, szexuális funkciókat megőrzi vagy javítja, és elfogadható szövődményrátát biztosít kellő tapasztalatú centrum választása esetén. A pácienseket minden esetben kötelező informálni arról, hogy a módszer fő hátránya, hogy a képzett pénisz az esetek legnagyobb többségében a közösülésre nem alkalmas.
Az FtM nemi megerősítő genitália műtétek során a komplex igények figyelembevétele elengedhetetlen, így egyértelmű, hogy pusztán egyetlen sebészeti módszer alkalmazása nem lehet a siker kulcsa. Centrumok kialakítása elsődleges prioritás lenne nemzetközi és hazai szinten egyaránt, annak érdekében, hogy a transzegészségügyi ellátás minősége javulhasson. A transzegészségügyi sebészeti munkacsoport széles körű rekonstrukciós tapasztalata, magas esetszáma, kellő számú szakmailag kompetens professzionális specialista bevonása, nemzetközi egységes irányelvek és kritériumrendszerek használata, más nemzetközi transzegészségügyi intézményekkel való kooperáció nagyon fontos tényezők a központok esetleges kialakításában.
References
1. Lebovic GS, Laub DR. Metoidioplasty. In: Ehrlich RM, Alter GJ. (eds.) Reconstructive and plastic surgery of the external genitalia. Philadelphia: WB Saunders Co.; 1999. p. 355–360.
2. Djordjevic ML, Stanojevic D, Bizic M, et al. Metoidioplasty as a single stage sex reassignment surgery in female transsexuals: Belgrade experience. J Sex Med 2009; 6: 1306–13. https://doi.org/10.1111/j.1743-6109.2008.01065.x
3. De Cuypere G, T’Sjoen G, Beerten R et al. Sexual and physical health after sex reassignment surgery. Arch Sex Behav 2005; 34: 679–90. https://doi.org/10.1007/s10508-005-7926-5
4. Djordjevic ML, Bizic MR. Comparison of two different methods for urethral lengthening in female to male (metoidioplasty) surgery. J Sex Med 2013; 10: 1431–8. https://doi.org/10.1111/jsm.12108
5. Takamatsu A, Harashina T. Labial ring flap: a new flap for metaidoioplasty in female-to-male transsexuals. J Plast Reconstr Aesthet Surg 2009; 62: 318–25. https://doi.org/10.1016/j.bjps.2008.11.038
6. Perovic SV, Djordjevic ML. Metoidioplasty: a variant of phalloplasty in female transsexuals. BJU Int 2003; 92: 981–5. https://doi.org/10.1111/j.1464-410X.2003.04524.x
7. Djordjevic ML, Bizic M, Stanojevic D, et al. Urethral lengthening in metoidioplasty (female-to-male sex reassignment surgery) by combined buccal mucosa graft and labia minora flap. Urology 2009; 74: 349–53. https://doi.org/10.1016/j.urology.2009.02.036
8. Hage JJ, Turnhout WM. Long-term outcome of metoidioplasty in 70 female to male transsexuals. Ann Plast Surg 2006; 57: 312–6. https://doi.org/10.1097/01.sap.0000221625.38212.2e
9. Rohrmann D, Jakse G. Urethroplasty in female to male transsexuals. Eur Urol 2003; 44: 611–4. https://doi.org/10.1016/S0302-2838(03)00356-7
Efficacy of neoadjuvant hormonal treatment before radical prostatectomy for locally advanced high-risk prostate carcinomas
DOI: 10.22591/magyurol.2019.1.berczics.3
Authors:
Berczi Csaba dr., Kiss Zoltán dr., Flaskó Tibor dr.
Debreceni Egyetem Általános Orvostudományi Kar, Urológiai Tanszék, Debrecen (igazgató: Flaskó Tibor dr.)
Summary
Aims: To measure the efficacy of neoadjuvant hormonal treatment before radical prostatectomy in patients with locally advanced high-risk prostate carcinomas.
Methods: From January 1996 to January 2018, 105 patients underwent radical prostatectomy for locally advanced high-risk prostate cancer. In Group 1 the patients received neoadjuvant hormonal therapy (n: 37), while in Group 2 the patients didn’t receive neoadjuvant hormonal treatment (n:68). In Group 1, the mean age of the patients was 64.1±6.8 years and the mean PSA level was 31.5 ng/ml. In Group 2, the mean age of the patients was 63.7±6.3 years, and the mean PSA concentration was 20.5 ng/ml. In all cases the preoperative radiological examinations showed locally advanced tumor.
Results: Histology showed locally advanced tumor (pT3) in 8 cases (21.6%) in Group 1, and in 41 patients (60.2%) in Group 2 (p=0.073). Margin positivity was detected in 8 occasions (21.6%) in Group 1, while it was present in 28 cases (41.7%) in Group 2 (p=0.043).
The median follow-up period was 58 month. In Group 1, biochemical progression developed in 8 patients (21.6%), local recurrence in 1case (2.7%) and distant metastasis in 3 occasions (8.1%) during this period. In Group 2, biochemical progression was diagnosed in 12 cases (17.6%), local recurrence in 3 patients (4.4%) and distant metastasis in 1 occasion (1.4%).
There were no significant deviations in these parameters in the two groups. Tumor specific mortality didn’t occur during the follow-up period.
Conclusions: The results showed that the neoadjuvant hormonal therapy provides better – but not significantly better – local tumor control in locally advanced high-risk prostate carcinomas. However, the neoadjuvant hormonal therapy didn’t prove any advantage according to tumor progression.
LAPSZÁM: MAGYAR UROLÓGIA | 2019 | 31. ÉVFOLYAM, 1. SZÁM
Összefoglalás
Cékitűzés: A neoadjuváns hormonkezelés hatékonyságának vizsgálata a lokálisan előrehaladott magas rizikójú prosztatatumorok esetében végzett radikális prostatectomiák során.
Módszer: A tanulmányban a 1996.01.01 és 2018.01.01. között, a klinikailag lokálisan előrehaladott magas rizikójú prosztatadaganat miatt radikális prostatectomián átesett 105 beteg adatai kerültek feldolgozásra. Az 1. csoportba (n: 37) tartozó betegek a műtét előtt neoadjuváns hormonkezelést kaptak. A 2. csoportba sorolt betegek (n: 68) nem részesültek hormonkezelésben. Az 1. csoportban az átlagos életkor 64,1±6,8 év, míg az átlagos PSA-szint 31,5 ng/ml. A 2. csoportban az átlagos életkor 63,7±6,3 év, míg az átlagos PSA-szint 20,5 ng/ml volt. Valamennyi esetben a műtét előtt elvégzett képalkotó-vizsgálat lokálisan előrehaladott tumort mutatott.
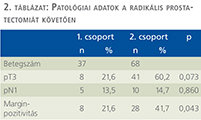
Eredmények: A szövettani vizsgálat az 1. csoportban, 8 esetben (21,6%), míg a 2. csoportban, 41 alkalommal (60,2%) igazolt lokálisan előrehaladott (pT3) daganatot (p=0,073). Margin-pozitivitás az 1. csoportban, 8 esetben (21,6%), míg a 2. csoportban, 28 betegben (41,7%) fordult elő (p=0,043).
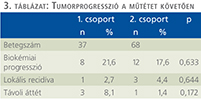
A medián 58 hónapos utánkövetés alatt az 1. csoportban biokémiai progressziót 8 (21,6%), lokális recidívát 1 (2,7%), míg távoli metasztázist 3 (8,1%) betegben diagnosztizáltak.
A 2. csoportban biokémiai progresszió 12 (17,6%), lokális recidíva 3 (4,4%), míg távoli metasztázis 1 (1,4%) esetben fordult elő. Ezen vizsgált mutatókban a két csoport között nem volt szignifikáns eltérés. Tumorspecifikus mortalitás egyik csoportban sem fordult elő.
Következtetések: Az eredmények alapján a klinikailag lokálisan előrehaladott magas rizikójú prosztatadaganatok esetében a neoadjuváns hormonkezelés jobb, de nem szignifikánsan jobb lokális tumorkontrollt biztosított. A későbbi tumorprogresszió szempontjából a neoadjuváns hormonkezelés nem nyújtott lényeges előnyt.
Bevezetés
A prosztatakarcinóma a férfiakban leggyakrabban előforduló rosszindulatú daganatos megbetegedés. Míg az alacsony és a közepes rizikójú prosztatatumorok jól kezelhetőek, addig a magas rizikójú daganatok terápiája még nem teljesen megoldott. Jelenleg a magas rizikójú prosztatadaganatok kezelése során mind a hormonkezeléssel kombinált sugárkezelés, mind pedig a multimodális kezelés eredményesen alkalmazható (1–6). A multimodális terápia során a radikális prostatectomiát követően a szövettani eredménytől és a műtét utáni PSA-szinttől függően adjuváns vagy salvage sugárkezelést alkalmazhatunk. A definitív sugárkezeléssel kapcsolatban a randomizált klinikai vizsgálatok eredményei azt mutatták, hogy az irradiáció mellett adott hormonkezelés – különösen a hosszan tartó hormonkezelés – javítja az onkológiai eredményességet (7–11). A radikális prostatectomia előtt alkalmazható neoadjuváns hormonkezeléssel kapcsolatos álláspontok jelenleg nem egyértelműek. Az Európai Urológus Társaság módszertani levele alapján a neoadjuváns hormonkezelés alkalmazása nem javasolt a magas rizikójú prosztatadaganatok miatt végzett radikális műtét előtt. Ugyanakkor több vizsgálat eredménye azt mutatta, hogy a neoadjuváns hormonkezelés mellett jobb a lokális tumorkontroll. A neoadjuváns hormonkezelés eredményessége a tumorprogresszió gyakoriságának csökkentése és a tumorspecifikus túlélés javításának szempontjából egyelőre nem igazolt a multimodális kezelés során (3).
Jelen tanulmányunkban vizsgáltuk a magas rizikójú, lokálisan előrehaladott prosztatadaganatos betegekben végzett radikális prostatectomiák előtt adott neoadjuváns hormonkezelés eredményességét. Vizsgáltuk a neoadjuváns hormonkezelés utáni radikális prostatectomiák szövettani feldolgozása során a lokálisan előrehaladott daganat és a sebészi szél tumoros infiltrációjának gyakoriságát. Elemeztük az utánkövetés során a biokémiai progresszió, valamint a lokális tumorrecidíva és távoli áttét kialakulásának gyakoriságát a neoadjuváns hormonkezelést kapott és nem kapott csoportban.
Betegek és módszerek
A DE Urológiai Klinikáján 1996.01.01. és 2018.01.01. között 105 betegben végeztünk radikális prostatectomiát klinikailag lokálisan előrehaladott magas rizikójú prosztatadaganat miatt. A prosztatadaganatok magas rizikócsoportba való besorolása az Európai Urológus Társaság (EAU) erre vonatkozó beosztása szerinti történt.
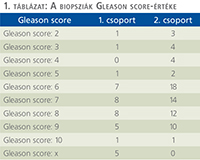
A prosztata-biopsziák szövettani vizsgálata során a Gleason grade rendszert alkalmaztuk (1. táblázat).
A magas rizikójú daganatos betegekben, valamennyi esetben képalkotó-vizsgálatot végeztünk a tumor helyi kiterjedtségének meghatározása céljából. Korábban CT, majd a későbbiekben, amikor már volt lehetőségünk MRI-vizsgálatok elvégzésére, MRI-vizsgálatokat végeztünk. Az eltelt időtartam alatt különböző típusú és érzékenységű CT- és MRI-készüléket használtunk klinikánkon. Több alkalommal azonban a beteg más kórházból hozta magával a CT vagy MRI eredményét. A klinikánkon végzett MRI-vizsgálatok 2015.09.01-ig 1 Teslás érzékenységű készülékkel, míg azt követően 3 Teslás készülékkel végezték. Az endorectalis MR-vizsgálatok 1 Teslás készülékkel történtek.
A klinikailag lokálisan előrehaladott magas rizikójú tumoros betegeket két csoportba soroltuk.
- Az 1. csoportba (n: 37) tartozó betegek a műtét előtt neoadjuváns hormonkezelést kaptak.
- A 2. csoportba sorolt betegek (n:68) nem részesültek hormonkezelésben az operáció előtt.
Az 1. csoportban az átlagos életkor 64,1±6,8 év, míg az átlagos PSA-szint 31,5 ng/ml. A 2. csoportban az átlagos életkor 63,7±6,3 év, míg az átlagos PSA-szint 20,5 ng/ml volt. A neoadjuváns hormonkezelés időtartama 3 és 6 hónap között változott.
Valamennyi esetben a műtét előtt végzett képalkotó-vizsgálat lokálisan előrehaladott tumort mutatott. A műtét előtti kivizsgálás során az 1. csoportban a CT-vizsgálat 6 betegben, kismedencei MRI 25 esetben, míg az endorectalis MRI 7 alkalommal mutatott cT3 stádiumú daganatot. A preoperatív kivizsgálás alkalmával a 2. csoportban a CT-vizsgálat 11 betegben, kismedencei MRI 46 esetben, s az endorectalis MRI 12 alkalommal mutatott lokálisan előrehaladott tumort. Mindkét csoportban volt egy-egy olyan beteg, akinek előbb CT-, majd MRI-vizsgálatot is végeztek, és ezt követően utalták klinikánkra.
Az elvégzett képalkotó-vizsgálatok távoli áttétet egyik betegben sem mutattak.
A radikális prostatectomiát az 1. csoportban, 28 esetben laparoszkópos és 9 betegben nyílt műtéti feltárással végeztük. A 2. csoportban a beavatkozás 53 alkalommal laparoszkópos, míg 15 esetben nyílt műtéti feltárással történt.
A szövettani stádium meghatározása a 2009. UICC TNM-rendszer szerint történt retrospektíve.
A műtétet követően az aktuális kezelési protokoll szerint obszervációt, adjuváns irradiációt, salvage irradiációt és hormonkezelést alkalmaztunk.
A betegek utánkövetése során PSA-vizsgálat az első 3 évben 3 havonta, azt követően az 5. évig 6 havonta, majd ezután évente történt. Képalkotó-vizsgálatot (CT, MRI, csontizotóp- vizsgálat) PSA-emelkedés vagy a beteg panaszai végeztünk. A biokémiai progressziót úgy definiáltuk, hogy olyan PSA-emelkedés, amely 0,2 ng/ml fölé történt (legalább 2 alkalommal).
Az átlagadatok mellett ± standard deviációt adtuk meg. A statisztikai analízist Student-féle t-próbával végeztük. A 0,05-nél kisebb p-értékeket tekintettük szignifikánsnak.
Eredmények
Az 1. csoportban a szövettani vizsgálat 8 esetben (21,6%) igazolt lokálisan előrehaladott (pT3) daganatot, 5 alkalommal (13,5%) a nyirokcsomók tumoros infiltrációját (pN1) és 8 betegben (21,6%) margin-pozitivitást mutatott (2. táblázat). A 2. csoportban pT3 stádiumú tumort 41 alkalommal (60,2%), nyirokcsomó-pozitivitást 10 (14,7%), míg a sebészi szél tumoros beszűrtségét 28 betegben (41,7%) észlelte a hisztológiai vizsgálat. A lokálisan előrehaladott prosztatakarcinóma lényegesebben gyakrabban fordult elő a neoadjuváns hormonkezelést nem kapott csoportban, de az eltérés nem volt szignifikáns (p=0,073). A nyirokcsomó-pozitivitás hasonló mértékben volt jelen mindkét csoportban (p=0,86). A margin-pozitivitás szignifikánsan ritkábban fordult elő a neoadjuváns hormonkezelést kapott betegekben (p=0,043).
A betegek átlagos utánkövetése 58±48 hónap volt.
Az átlagosan csaknem 5 éves utánkövetési idő alatt az 1. csoportban biokémiai progressziót 8 (21,6%), lokális recidívát 1 (2,7%), míg távoli metasztázist 3 (8,1%) betegben diagnosztizáltunk (3. táblázat). A 2. csoportban biokémiai progresszió 12 (17,6%), lokális recidíva 3 (4,4%), míg távoli metasztázis 1 (1,4%) esetben fordult elő. Ezen vizsgált mutatókban a két csoport között nem volt szignifikáns eltérés.
A betegek utánkövetése alatt tumorspecifikus mortalitás egyik csoportban sem fordult elő.
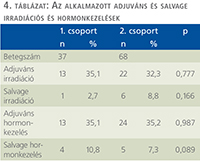
A magas rizikójú prosztatadaganatos betegek esetében az aktuális protokollnak megfelelően a beteg-compliance és preferencia figyelembevételével obszervációt, adjuváns irradiációt, salvage irradiációt és hormonkezelést alkalmaztunk (4. táblázat). Az 1. csoportban adjuváns és salvage sugárkezelés az esetek 35,1 és 2,7%-ában, míg a 2. csoportban a betegek 32,3%-ában és 8,8%-ában történt. A radikális prostatectomia után adjuváns és salvage hormonkezelést az 1. csoportban az esetek 35,1% és 10,8%-ában, míg a 2. csoportban a betegek 35,2 és 7,3%-ában alkalmaztunk.
Megbeszélés
Az irodalmi adatok alapján az újonnan felfedezett prosztatadaganatos betegek 5-15%-ában fordul elő lokálisan előrehaladott tumor (12, 13).
A lokálisan előrehaladott, magas rizikójú prosztatadaganatos betegek kuratív ellátására a hagyományos kezelési lehetőség a sugárkezelés és emellett hormonterápia.
Jelenleg nincs olyan randomizált klinikai tanulmány, amely a lokálisan előrehaladott prosztatadaganatok kezelése során összehasonlítaná a radikális prostatectomia és a sugárkezeléssel kombinált hormonterápia eredményességét. Boorjian és munkatársai több retrospektív vizsgálat analízise során azt találták, hogy a radikális prostatectomia után (ha az a multimodális kezelés részeként volt alkalmazva) a 10 éves általános túlélés jobb, mintha a beteg irradiációt és hormonkezelést kapott (14–17). Az utóbbi időben a lokálisan előrehaladott prosztatadaganatoknál – különösen a fiatal, egészséges, kis volumenű tumorral rendelkező betegekben – egyre jobban előtérbe kerül a multimodális kezelés, amely a radikális prostatectomia és a sugárkezelés kombinációját foglalja magába (13, 18).
Célszerű azonban figyelembe venni, hogy a klinikailag lokálisan előrehaladott tumor diagnózisa a képalkotó-vizsgálatokon alapszik, amelyek érzékenysége még nem teljesen megbízható. Így a kivizsgálás alkalmával végzett képalkotó-vizsgálatok során nemcsak „down staging”, hanem „overstaging” is előfordulhat. Az EORTC 30001 vizsgálat során azt tapasztalták, hogy az eredetileg lokálisan előrehaladott daganat miatt végzett műtét után a szövettan az esetek 43,8%-ában szervre lokalizált tumort mutatott (19). Ward és munkatársai a cT3 stádiumú prosztatakarcinómák miatt végzett radikális prostatectomiák után 27%-ban közöltek pT2 stádiumú daganatot (20). Saját anyagunkban a neoadjuváns hormonkezelést nem kapott csoportban a végleges szövettan szerint szervre lokalizált tumor az esetek 39,8%-ában fordult elő. Így betegeink jelentős részében is a képalkotó-vizsgálatok szempontjából „overstaging” volt észlelhető.
A lokálisan előrehaladott tumor miatt végzett radikális prostatectomiák során alkalmazott neoadjuváns hormonkezeléssel kapcsolatos vélemények megoszlanak. A legtöbb ezzel kapcsolatos publikáció eredményei szerint bár a lokális tumorkontroll javul, de a neoadjuváns hormonkezelés a progressziómentes túlélés és az általános túlélés szempontjából nem nyújt előnyt (21–23). Ugyanakkor a Cochrane-adabázisban megjelent metaanalízis szerint a tumorkiújulás szignifikánsan csökkent a neoadjuváns hormonkezelés mellett (24).
A lokálisan előrehaladott prosztatadaganatokban a neoadjuváns hormonkezelés segíthet a daganat operábilissá válásában, hogy a lokális tumorkontroll javuljon. McKay és munkatársai 10 klinikai vizsgálatot áttekintő metaanalízisükben arról számoltak be, hogy a neoadjuváns hormonkezelés után szignifikánsan csökken a daganat patológiai T-stádiuma, növekszik a szervre lokalizált tumorok aránya, csökken a margin-pozitív esetek száma és csökken a nyirokcsomó-áttétek száma (25).
A Southwest Oncology Group Study 9109 során a neoadjuváns hormonkezelés hatását vizsgálták klinikailag T3- és T4-stádiumú betegekben. Úgy találták, hogy a műtétet követően 56%-ban volt szervre lokalizált daganat, míg a sebészi szél pozitivitása az esetek 26%-ában volt kimutatható. A 10 éve progressziómentes túlélés 40%, míg a 10 éves általános túlélés 68% volt (26).
Hsu és munkatársai több vizsgálatuk során arról számoltak be, hogy a cT3-stádiumú prosztatadaganatos betegekben végzett radikális prostatectomiát követően a 10 éves biokémiai progressziómentes túlélés, a klinikai progressziómentes túlélés, a tumorspecifikus túlélés, valamint az általános túlélés szempontjából a daganat differenciáltsága, a margin-pozitivitás, valamint a nyirokcsomóstátusz volt szignifikáns prognosztikai tényező (27–29).
Saját anyagunkban a neoadjuváns hormonkezelés mellett szignifikánsan csökkent a margin-pozitív esetek száma, de a tumorprogresszió szempontjából szignifikáns eltérést nem tapasztaltunk a másik csoporthoz viszonyítva.
Figyelembe véve, hogy több tanulmányban úgy találták, hogy a lokálisan előrehaladott daganatokban a neoadjuváns hormonkezelés mellett javul a lokális tumorkontroll, így ez elméletileg hathat a prognosztikai faktorokra is. Ugyanakkor ilyen esetekben a neoadjuváns hormonkezelés eredményessége a tumorprogresszió szempontjából jelenleg nem bizonyított.
Következtetések
Összegzésül megállapíthatjuk, hogy az eredmények alapján a klinikailag lokálisan előrehaladott magas rizikójú prosztatadaganatok miatt végzett radikális prostatectomiák esetében a neoadjuváns hormonkezelés jobb, de nem szignifikánsan jobb lokális tumorkontrollt biztosított. A későbbi tumorprogresszió szempontjából a neoadjuváns hormonkezelés nem nyújtott lényeges előnyt. A neoadjuváns hormonkezelést követően nem csökkent az alkalmazott adjuváns és salvage kezelések száma sem.
References
1. Berczi Cs, Kiss Z, Flaskó T. A radikális prostatectomia hatékonysága a magas rizikójú prosztata daganatok kezelésére. Magyar Urológia 2018; 2: 55–59. https://doi.org/10.22591/magyurol.2018.2.berczics.55
2. Feldman AS, Meyer CP, Sanchez A, Krasnova A, Reznor G, Menon M, Kibel AS, Choueiri TK, Lipsitz SR, Sun M, Trinh QD. Morbidity and Mortality of Locally Advanced Prostate Cancer: Population Based Analysis Comparing Radical Prostatectomy versus External Beam Radiation. J Urol 2017 Nov; 198(5): 1061–1068. https://doi.org/10.1016/j.juro.2017.05.073
3. Froehner M, Wirth MP. Locally advanced prostate cancer: optimal therapy in older patients. Drugs Aging 2013 Dec; 30(12): 959–67. https://doi.org/10.1007/s40266-013-0123-7
4. Jani AB. Management strategies for locally advanced prostate cancer. Drugs Aging. 2006; 23: 119–29. https://doi.org/10.2165/00002512-200623020-00003
5. Joniau SG, Van Baelen AA, Hsu CY, Van Poppel HP. Complications and functional results of surgery for locally advanced prostate cancer. Adv Urol 2012; 2012: 706309. https://doi.org/10.1155/2012/706309
6. Wirth MP, Hakenberg OW, Froehner M. Optimal treatment of locally advanced prostate cancer. World J Urol 2007; 25: 169–76. https://doi.org/10.1007/s00345-007-0158-7
7. Denham JW, Steigler A, Lamb DS , Joseph D, Turner S, Matthews J, Atkinson C, North J, Christie D, Spry NA, Tai KH, Wynne C, D’Este C. Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 2011; 12(5): 451–9. https://doi.org/10.1016/S1470-2045(11)70063-8
8. Fossa SD, Wiklund F, Klepp O, Angelsen A, Solberg A, Damber JE, Hoyer M, Widmark A, The Scandinavian Prostate Cancer Group-7 Investigators. Ten- and 15-yr Prostate Cancer-specific Mortality in Patients with Nonmetastatic LocallyAdvanced or Aggressive Intermediate Prostate Cancer, Randomized to Lifelong EndocrineTreatment Alone or Combined with Radiotherapy: Final Results of The Scandinavian Prostate Cancer Group-7. Eur Urol 2016 Oct; 70(4): 684–691. https://doi.org/10.1016/j.eururo.2016.03.021
9. Horwitz EM, Bae K, Hanks GE Porter A, Grignon DJ, Brereton HD, Venkatesan V, Lawton CA, Rosenthal SA, Sandler HM, Shipley WU. Ten-year follow-up of radiation therapy oncology group protocol 92-02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 2008; 26(15): 2497–504. https://doi.org/10.1200/JCO.2007.14.9021
10. Mottet N, Peneau M, Mazeron JJ, Molinie V, Richaud P. Addition of radiotherapy to long-term androgen deprivation in locally advanced prostate cancer: an open randomised phase 3 trial. Eur Urol 2012;62:213–9. https://doi.org/10.1016/j.eururo.2012.03.053
11. Sridharan S, Dal Pra A, Catton C, Bristow RG, Warde P. Locally advanced prostate cancer: current controversies and optimisation opportunities. Clin Oncol (R Coll Radiol). 2013 Aug; 25(8): 499–505. https://doi.org/10.1016/j.clon.2013.04.004
12. Center MM, Jemal A, Lortet-Tieulent J, Ward E, Ferlay J, Brawley O, Bray F. International variation in prostate cancer incidence and mortality rates. Eur Urol 2012 Jun; 61(6): 1079–92. https://doi.org/10.1016/j.eururo.2012.02.054
13. Faria EF, Carvalhal GF, Vieira RA, Silva TB, Mauad EC, Tobias-Machado M, Carvalho AL. Comparison of clinical and pathologic findings of prostate cancers detected through screening versus conventional referral in Brazil. Cooperative Brazilian Uro-oncology Group (CBUG). Clin Genitourin Cancer 2011 Dec; 9(2): 104–8. https://doi.org/10.1016/j.clgc.2011.06.004
14. Bolla M, Van Poppel H, Collette L, van Cangh P, Vekemans K, Da Pozzo L de Reijke TM, Verbaeys A, Bosset JF, van Velthoven R, Colombel M, van de Beek C, Verhagen P, van den Bergh A, Sternberg C, Gasser T, van Tienhoven G, Scalliet P, Haustermans K, Collette L; European Organisation for Research and Treatment of Cancer, Radiation Oncology and Genito-Urinary Groups. Department of Radiation Oncology, Centre Hospitalier Universitaire A Michallon, Grenoble, France. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet 2012; 380: 2018–2027. https://doi.org/10.1016/S0140-6736(12)61253-7
15. Boorjian SA, Karnes RJ, Viterbo R, Rangel LJ, Bergstralh EJ, Horwitz EM, Blute ML, Buyyounouski MK. Long-term survival after radical prostatectomy versus external-beam radiotherapy for patients with high-risk prostate cancer. Cancer. 2011 Jul 1; 117(13): 2883–91. https://doi.org/10.1002/cncr.25900
16. Lange PH. Is surgery good for advanced localised prostate cancer? It’s time to find out! Eur Urol 2007; 51: 873–875. https://doi.org/10.1016/j.eururo.2006.09.044
17. Thompson IM Jr, Tangen CM, Paradelo J, Lucia MS, Miller G, Troyer D, Messing E, Forman J, Chin J, Swanson G, Canby-Hagino E, Crawford ED. Adjuvant radiotherapy for pathologicallyadvanced prostate cancer: a randomised clinical trial. J Am Med Assoc 2006; 296: 2329–2335. https://doi.org/10.1001/jama.296.19.2329
18. Lowrance WT, Elkin EB, Yee DS, Feifer A, Ehdaie B, Jacks LM, Atoria CL, Zelefsky MJ, Scher HI, Scardino PT, Eastham JA. Locally advanced prostate cancer: a population-based study of treatment patterns. BJU Int. 2012 May; 109(9): 1309–14. https://doi.org/10.1111/j.1464-410X.2011.10760.x
19. Van Poppel H, Vekemans K, Da Pozzo L, Bono A, Kliment J, Montironi R, Debois M, Collette L. Radical prostatectomy for locally advanced prostate cancer: results of a feasibility study (EORTC30001). Eur J Cancer 2006 May; 42(8): 1062–7. https://doi.org/10.1016/j.ejca.2005.11.030
20. Ward JF, Slezak JM, Blute ML, Bergstralh EJ, Zincke H. Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate-specific antigen testing: 15-year outcome. BJU Int 2005 Apr; 95(6): 751–6. https://doi.org/10.1111/j.1464-410X.2005.05394.x
21. Gleave ME, Goldenberg SL, Chin JL, Warner J, Saad F, Klotz LH, et al. Randomized comparative study of 3 versus 8-month neoadjuvant hormonal therapy before radical prostatectomy: biochemical and pathological effects. J Urol 2001; 166: 500–506. https://doi.org/10.1097/00005392-200108000-00021. https://doi.org/10.1016/S0022-5347(05)65971-X
22. Klotz LH, Goldenberg SL, Jewett MA, Fradet Y, Nam R, Barkin J, Chin J, Chatterjee S; Canadian Uro-Oncology Group. Long-term followup of a randomized trial of 0 versus 3 months of neoadjuvant androgen ablation before radical prostatectomy. J Urol 2003; 170: 791–794. https://doi.org/10.1097/01.ju.0000081404.98273.fd
23. Labrie F, Cusan L, Gomez JL, Diamond P, Suburu R, Lemay M, Tetu B, Fradet Y, Bélanger A, Candas B. Neoadjuvant hormonal therapy: the Canadian experience. Urology 1997; 49: 56–64. https://doi.org/10.1016/S0090-4295(97)00170-2
24. Kumar S, Shelley M, Harrison C, Coles B, Wilt TJ, Mason MD. Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. Cochrane Database Syst Rev 2006 Oct 18; (4): CD006019. Review https://doi.org/10.1002/14651858.CD006019.pub2
25. McKay RR, Choueiri TK, Taplin ME. Rationale for and review of neoadjuvant therapy prior to radical prostatectomy for patients with high-risk prostate cancer. Drugs 2013 Sep; 73(13): 1417–30. https://doi.org/10.1007/s40265-013-0107-2
26. Berglund RK, Tangen CM, Powell IJ, Lowe BA, Haas GP, Carroll PR, Canby-Hagino ED, deVere White R, Hemstreet GP 3rd, Crawford ED, Thompson IM Jr, Klein EA. Ten-year follow-up of neoadjuvant therapy with goserelin acetate and flutamide before radical prostatectomy for clinical T3 and T4 prostate cancer: update on Southwest Oncology Group Study 9109. Urology 2012; 79: 633–7.
27. Hsu CY, Joniau S, Roskams T, Oyen R, van Poppel H. Comparing reults after surgery in patients with clinical unilateral T3a, prostate cancer treated with or without neoadjuvant androgen deprivation therapy. BJU Int 2006; 99: 311–4.
28. Hsu CY, Joniau S, Oyen R, Roskams T, van Poppel H. Outcome of surgery for clinical clinical unilateral T3a: a single institution experience. Eur Urol 2007; 51: 121–9.
29. Srivatsa N, Nagaraja H, Shweta S, Raghunath SK. Radical Prostatectomy for Locally Advanced Prostate Cancers-Review of Literature. Indian J Surg Oncol 2017; 8(2): 175–180.